Christine Erbe (1), Doug Nowacek (2), Rachel Przeslawski (3), Daniel P. Costa (4)
(1) Centre for Marine Science and Technology, Curtin University, Perth, Australia
(2) Duke University Marine Lab, Beaufort, USA
(3) Geoscience Australia, Canberra, Australia
(4) Department of Ecology and Evolutionary Biology, University of California Santa Cruz, USA
Traduction: Laurent Chauvaud (Université de Bretagne Occidentale) & Delphine Mathias (Société d’Observation Multi-Modale de l’Environnement)
Dans l’océan, le bruit doit être considéré comme une forme de pollution qui peut affecter la faune depuis le microzooplancton jusqu’aux baleines. Il peut interférer avec leur perception acoustique de l’environnement océanique et leur communication, perturber leur comportement et les contraindre à fuire, déséquilibrer l’équilibre établi entre absorption de nourriture et dépense énergétique , provoquer des lésions et des traumatismes, et finalement avoir un impact évident sur la santé et la survie des espèces sous contraintes sonores. L’océan Austral n’est pas indemne. Cependant, très peu d’études sur les impacts bioacoustiques ont été entreprises sur les espèces antarctiques de l’océan Austral. Nous présentons ici un aperçu des sources de bruit sous-marin dans l’océan Austral, de ses impacts potentiels, des options d’atténuation, ainsi que des besoins en matière de gestion et de recherche.
Sources de bruit sous-marin dans l'océan Austral
L’océan n’est pas un endroit tranquille. Il abrite une myriade de sons qui proviennent non seulement de l’océan lui-même et de sa faune, mais il contient aussi des sons provenant de sa surface et du fond. Ces sons se propagent dans l’eau de mer. Les sources sonores naturelles sont par ailleurs diverses et comprennent d’abord la géophonie c’est à dire les bruits provoqués par le vent qui souffle sur l’eau de mer et sur la glace, les précipitations sur la mer ou la glace de mer, les vagues déferlantes, les volcans sous-marins, les tremblements de terre et les glissements de terrain, ainsi que la rupture de la glace. Les sources sonores biotiques dont l’ensemble forme la biophonie comprennent les bruits produits par les invertébrés , les poissons, les sifflements des dauphins, le cliquetis des baleines à dents, le chant des phoques et des baleines à fanons.
Les sources et les niveaux de bruit sous-marin varient en fonction du lieu, de l’heure, de la saison et des fréquences sonores caractéristiques de ce bruit. Les paysages acoustiques sous-marins autour de l’Antarctique présentent une grande variabilité spatio-temporelle, en raison des changements saisonniers de la glace de mer. La couverture de glace peut atténuer le son entre quelques hertz et 500 Hz, mais aussi ajouter du son dans cette bande de fréquence, en particulier le long de la lisière de la glace. Le son de la glace peut être à la fois tonal (frottement des icebergs) et pulsé (craquement de la glace). Le vent qui souffle sur la haute mer et sur la glace mince génère un son sous-marin continu et à large bande de quelques dizaines de hertz à 20 kHz. La mégafaune marine émet des appels uniques (qui durent quelques secondes), des sons arrangés en chants (qui durent de quelques heures à quelques jours) et des chœurs (lorsque plusieurs appels et/ou de chants se chevauchent jusqu’à élever le spectre sonore ambiant dans la bande de fréquence correspondante). La mégafaune vocalisante comprend les baleines bleues de l’Antarctique (Balaenoptera musculus intermedia ; 18-27 Hz), les rorquals communs (B. physalus ; 15-30 Hz et 90-100 Hz), les petits rorquals de l’Antarctique (B. bonaerensis ; 100-300 Hz), le phoque de Weddell (Leptonychotes weddelli ; 100 Hz – 15 kHz) et le phoque léopard (Hydrurga leptonyx ; 50 Hz – 6 kHz)1, 2. Et si les baleines ne sont présentes que pendant l’été austral, les phoques sont présents toute l’année.
Au cours des dernières décennies, l’océan Austral a été de plus en plus soumis au bruit anthropique des navires de croisière, des navires de recherche, des bateaux de pêche, des sonars, des canons à air sismique et de la construction occasionnelle de stations de recherche et de quais. Toutes les régions de l’Antarctique n’ont pas été touchées de la même manière. C’est plutôt la côte Pacifique Sud de l’Antarctique (entre la mer de Ross et la péninsule Antarctique) qui est la plus visitée3. Par ailleurs, le trafic maritime n’a cessé d’augmenter ces dernières années, même s’il n’existe pas de routes maritimes internationales dans l’océan Austral. La présence de navires de tourisme (mesurée en jours-navire) est plus de deux fois supérieure à celle des navires de pêche, et trois fois supérieure à celle des navires de recherche ces dernières années. Le nombre de voyages en bateau de tourisme a triplé entre 1999 et 2019 et continue d’augmenter (voir les résumés des données dans3). L’activité des navires de recherche a également augmenté, tandis que celle des navires de pêche est restée plus stable. Les navires touristiques sont limités à l’été austral, et c’est également la saison de pointe pour les navires de recherche et les navires de service (c’est-à-dire les brise-glaces desservant les stations de recherche). Les navires de pêche sont présents toute l’année, en dehors des glaces de mer, donc à une latitude plus basse en hiver.
Le bruit des navires est dû à la cavitation des hélices ainsi qu’aux bruits des moteurs et des machines qui sont transmis à l’eau par la coque. Le bruit émis est alors à large bande (10 Hz-20 kHz) et il sera continu. Les brise-glaces génèrent également du bruit lorsqu’ils brisent la glace. Les navires de recherche sismique remorquent une série de canons à air qui libèrent de manière répétée de l’air sous haute pression dans l’eau, créant une série d’impulsions acoustiques aiguës (5 Hz – 20 kHz, toutes les 5 à 20 s). Précisons que les études sismiques marines sont utilisées pour étudier la croûte terrestre, sa structure et sa géologie. Tous les navires sont équipés d’échosondeurs pour la navigation qui émettent un ping acoustique (>10 kHz) à une fréquence de quelques secondes3. Le niveau reçu dépend d’un certain nombre de facteurs, tels que la bathymétrie (peu profonde, inclinaison de la pente du fond ou profonde), la géologie du fond marin (propriétés édaphiques du fond), les profils de température et de salinité de la colonne d’eau, la profondeur à laquelle le récepteur est situé et, bien sûr, la distance à la source4. Dans de bonnes conditions, le son d’un navire peut se propager sur des centaines de kilomètres5 et des études sismiques ont été enregistrées à des milliers de kilomètres de distance6. Dans l’océan Austral, le son peut se propager sur de longues distances (des centaines de milliers de kilomètres7, 8) car les eaux froides de surface créent un conduit favorable en surface, tandis que la bathymétrie profonde empêche la perte d’énergie acoustique à basse fréquence. Par conséquent, le bruit marin de l’Antarctique peut avoir un impact sur la faune marine loin de la source sonore (figure 1).
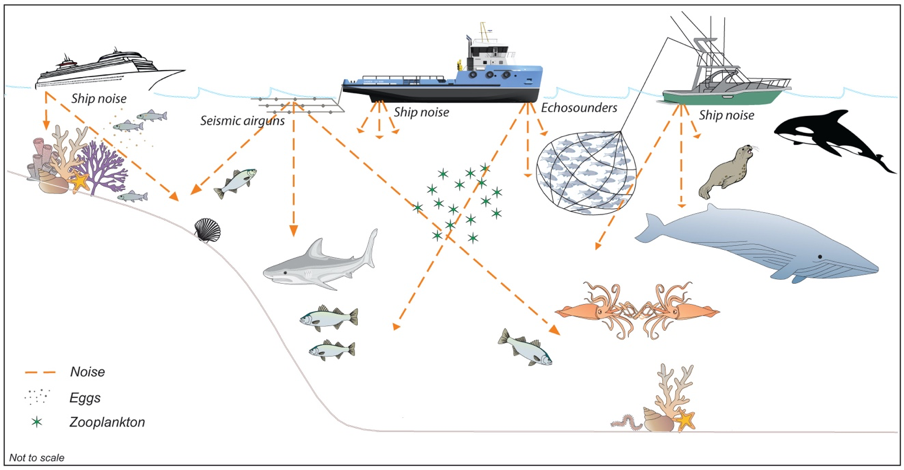
Figure 1. Schéma conceptuel montrant les sources sous-marines de bruit anthropiques et une partie de la faune antarctique qui pourrait être touchée. Les flèches orange indiquent les vecteurs d'ondes pointant dans les directions possibles de propagation du son. Le diagramme n'est pas exhaustif ; il n'indique pas non plus l'ampleur ou le type d'impact à considérer.
Impacts du bruit sur la faune marine
Le bruit sous-marin peut affecter la faune marine de différentes manières, depuis les impacts aigus transitoires à chroniques. Le bruit sous-marin peut modifier la biologie des animaux depuis leur comportement jusqu’à leur physiologie. Dans les cas extrêmes, les sources de bruit intense, telles que les grands réseaux sismiques ou les explosions sous-marines, peuvent provoquer des blessures immédiates, voire la mort, en particulier chez les petits animaux planctoniques9. Parmi les autres impacts aigus sont listés la perte d’audition, mais aussi les changements soudains de comportement et le stress, qui peuvent avoir des conséquences sur la santé de l’animal.
La perte auditive due au bruit peut être soit temporaire (c’est-à-dire un déplacement temporaire du seuil, TTS), soit permanente (c’est-à-dire un déplacement permanent du seuil, PTS). Étant donné l’importance du son pour de nombreux animaux marins, la déficience auditive peut affecter la communication acoustique, la navigation, la recherche de nourriture, la reproduction et d’autres fonctions également vitales. Un phoque commun captif (Phoca vitulina) a fait l’objet d’une expérience de 8 dB de STP (non récupéré après plus de 10 ans) après avoir été exposé à un bruit de 4 kHz à 181 dB re 1 µPa et 199 dB re 1 µPa2s, ressemblant à un sonar militaire à courte portée10. Une exposition aiguë au bruit peut entraîner soit une STT soit une STP, selon le niveau d’exposition. Les STP peuvent également se produire après une exposition chronique à un bruit de moindre intensité.
Les effets chroniques peuvent être impactant à l’échelle d’une population animale. Le bruit chronique peut contraindre des animaux à quitter leur habitat. Le déplacement est souvent considéré comme une réponse adéquate à une pollution sonore. Son impact est alors négligé puisque les animaux se déplacent simplement vers des régions plus calmes. Toutefois, les animaux choisissent des habitats pour des raisons écologiques et il n’y a peut-être pas de solutions de rechange appropriées. Des poissons ou des baleines reviennent de façon saisonnière dans des habitats essentiels à leur survie tels que les zones d’alimentation et de reproduction. Certaines baleines migratrices ingèrent une part importante de leur consommation alimentaire annuelle lorsqu’elles se trouvent dans leurs zones d’alimentation Antarctique11, mais la période pendant laquelle elles peuvent se nourrir est très limitée (environ trois mois). Des études sismiques à grande échelle, d’une durée de quelques semaines à quelques mois, ont montré qu’elles imposent le déplacement des rorquals communs dans l’Atlantique Nord ; cependant, ces animaux sont revenus après la fin de l’étude sismique12.
Le bruit peut également affecter le comportement acoustique (c’est-à-dire la production et l’utilisation des sons). L’augmentation du bruit chronique à basse fréquence provenant du transport maritime a probablement entraîné le déplacement permanent des vocalisations des baleines franches (Eubalaena sp.) vers des fréquences plus élevées13. Les baleines boréales (Balaena mysticetus ; une espèce de l’Arctique) ont augmenté à la fois leur taux et leur niveau de vocalisation en lien avec une augmentation du bruit naturel et provenant de relevés sismiques14; cependant, un seuil a été atteint, au-delà duquel les deux méthodes de compensation vocale ont commencé à échouer, entraînant une diminution du taux de vocalisation et un espace de communication réduit.
Enfin, il a été démontré que les oursins (Arbacia lixula15), les poissons (par exemple, le tilapia du Nil, Oreochromis niloticus16) et les baleines sont sensibles au stress induit par le bruit. Les niveaux d’hormones de stress glucocorticoïdes ont chuté chez les baleines franches pendant une période de réduction du bruit des navires17. Bien qu’une augmentation temporaire des hormones de stress ne soit pas préjudiciable (elles provoquent une réaction de lutte ou de fuite pour échapper à la menace), des niveaux élevés prolongés peuvent affecter les fonctions immunitaires et reproductives.
On comprend actuellement très peu les effets du bruit lorsque d’autres facteurs de stress, non acoustiques (par exemple, la pollution chimique ou l’épuisement des proies) sont considérés. Nous ne savons pas si le bruit peut contribuer à des interactions synergiques avec d’autres forçages anthropiques (c’est-à-dire si les effets de deux ou plusieurs facteurs de stress sont plus importants que la somme de leurs effets individuels). Les animaux peuvent être plus sensibles au stress acoustique en présence d’autres stresseurs. De multiples facteurs de stress peuvent conduire à un point de basculement où l’on peut alors observer les impacts du bruit ; cela peut s’appliquer en particulier au stress thermique18, auquel de nombreuses espèces de l’Antarctique peuvent être de plus en plus vulnérables19.
Table 1: Exemples d’impacts du bruit sur les espèces marines présentes dans l’océan Austral (* ou espèces similaires, non antarctiques). Ce tableau n’inclut pas les études montrant l’absence d’impact.
| Groupe taxonomique | Espèces | Source de bruit | Impact | Ref. |
| Zooplancton | *Copepoda, Cladocera | Canons à air comprimé sismiques | Réduction de l’abondance et de la survie | [9] |
| Coquilles Saint-Jacques | * Pétoncle commercial (Pecten fumatus) | Canons à air comprimé sismiques | Réponses comportementales et physiologiques | [20] |
| Oursins de mer | * Oursins de mer (Arbacia lixula) | Simulation de balayage d’échosondeur/sonar | Stress | [15] |
| Crustacés | * Homard de roche du sud (Jasus edwardsii) | Canons à air comprimé sismiques | Déficit de redressement, blessure de statocyste | [21] |
| Calmar | * Calmar de roche austral (Sepioteuthis australis) | Canons à air comprimé sismiques | Réaction de surprise, évitement | [22] |
| Poisson | * Cabillaud de l’Atlantique (Gadus morhua), saithe (Pollachius virens) | Canons à air comprimé sismiques | Changements dans le rythme cardiaque et le comportement | [23] |
| Oiseaux marins | *Manchot du cap (Spheniscus demersus) | Canons à air comprimé sismiques | Déplacement de l’aire d’alimentation préférée | [24] |
| Baleines à fanons | Baleine bleue de l’Antarctique (Balaenoptera musculus intermedia) | Sonar naval | Arrêt de la plongée d’alimentation, évitement
Augmentation du taux d’appel |
[25] |
| Baleines à fanons | Rorqual commun (Balaenoptera physalus) | Navires,
Canons à air comprimé sismiques |
Modification des caractéristiques de l’appel (durée, largeur de bande, fréquence de pointe) | [12] |
| Baleines à fanons | Baleine à bosse (Megaptera novaeangliae) | Navires,
Canons à air comprimé sismiques |
Réduction des interactions sociales | [26] |
| Baleines à dents | Orque (Orcinus orca) | Navires,
Sonar naval |
Comportement d’évitement | [27,28] |
| Baleines à dents | Cachalot (Physeter macrocephalus) | Sonar naval | Perturbation de la recherche de nourriture et du repos, évitement | [29] |
| Phoques | * Phoque tacheté (Phoca largha), * Phoque annelé (Pusa hispida) | Canons à air comprimé sismiques | Masquage acoustique | [30] |
| Phoques | * Éléphant de mer du Nord (Mirounga angustirostris) | Bruit en bande d’octave | TTS | [31] |
| Phoques | * Phoque barbu (Erignathus barbatus)
|
Canons à air comprimé sismiques | TTS | [32] |
| Phoques | * Éléphant de mer du Nord (Mirounga angustirostris) | Signal de recherche acoustique (ATOC) | Changement de comportement de plongée | [33] |
Options pour l'atténuation des impacts
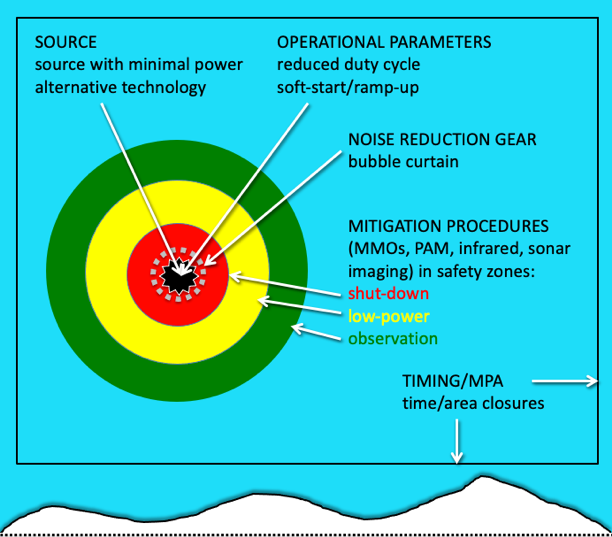
Figure 2. Schéma des options d'atténuation du bruit. Vue horizontale de l'océan près de la lisière de la glace. Les options d'atténuation sont indiquées à la source (c'est-à-dire en changeant la technologie ou les opérations), près de la source (c'est-à-dire en installant des équipements de réduction du bruit), dans les zones de surveillance (par exemple, en employant des observateurs de mammifères marins (MMO), une surveillance acoustique passive (PAM), des caméras infrarouges ou des systèmes d'imagerie par sonar) et à l'échelle de la zone (c'est-à-dire en limitant les opérations pendant certaines saisons ou dans les zones marines protégées AMP).
Pour réduire la probabilité et la gravité des impacts sonores, il convient d’abord de réduire l’exposition au bruit. Cela peut être réalisé par une technologie alternative (par exemple, des réseaux de canons à air sismiques plus petits ou des alternatives d’armes à air telles que des vibrateurs sismiques ou des navires plus silencieux), des modifications de la source sonore (par exemple, réduction de la puissance, de la gamme de fréquences ou d’autres caractéristiques du signal), des modifications opérationnelles (par exemple, réduction du cycle de fonctionnement ou augmentation de la puissance pour alerter les animaux) ou des systèmes de réduction du bruit (par exemple, rideaux de bulles autour du battage de pieux pour la construction de quais). Une surveillance in situ et en temps réel de la présence des animaux (avec par exemple, des observateurs de mammifères marins à bord, des drones équipés de caméras ou une localisation et un suivi acoustique passif avec un réseau d’hydrophones remorqué) peut informer la gestion sur place, qui peut ensuite réduire temporairement la puissance ou arrêter les travaux si des animaux sont à proximité. La planification préalable au projet permet de définir des périodes ou zones à éviter afin de ne pas réaliser les travaux à proximité d’habitats essentiels ou pendant des périodes critiques pour certaines espèces (Fig. 2).
Toutes les activités menées en Antarctique sont soumises à une évaluation préalable des incidences sur l’environnement en vertu des dispositions de l’Annexe I du protocole sur la protection de l’environnement du traité sur l’Antarctique. Toutefois, il n’existe pas d’organisme de réglementation unifié. Les activités de recherche sont évaluées par le pays signataire du Traité sur l’Antarctique. Le tourisme est géré par la Réunion consultative du Traité sur l’Antarctique (ATCM) et l’Association internationale des voyagistes de l’Antarctique (IAATO), et la pêche par la Commission sur la conservation de la faune et de la flore marines de l’Antarctique (CCAMLR). Les méthodes d’évaluation et d’autorisation des activités génératrices de bruit (par exemple, les études sismiques) peuvent varier d’une partie à l’autre du traité en fonction de la législation nationale spécifique.
Besoins en matière de recherche
Il existe peu d’informations sur les impacts du bruit sur les espèces des eaux antarctiques (Tableau 1), et il faut donc faire des déductions à partir d’espèces similaires et apparentées ailleurs. La validité de ces extrapolations est inconnue, étant donné les différences de bruit ambiant, de propagation du son et d’écologie. Un récent atelier sur les impacts du bruit sur les mammifères marins de l’Antarctique a identifié le besoin de disposer de meilleures informations sur l’abondance et la distribution des animaux et sur leurs capacités auditives, ainsi que d’une évaluation de l’efficacité des méthodes d’atténuation3. Si le bruit ambiant en Antarctique a été bien surveillé dans certaines régions, des mesures de référence sont nécessaires dans d’autres1. Les mesures de base du paysage sonore sont particulièrement importantes car le changement climatique entraîne des changements considérables dans l’étendue de la glace de mer, la fonte des glaciers et le calage des icebergs, qui ont tous une incidence sur le paysage sonore. En termes d’impacts sonores, si les impacts à court terme sur les individus de diverses espèces ont été bien étudiés, notre compréhension des facteurs de stress cumulatifs et multiples, et en particulier des effets sur les populations et les écosystèmes, est presque inexistante.
Besoins en matière de gestion
La gestion du bruit nécessite une approche interdisciplinaire, combinant la compréhension a) de la physique et de l’ingénierie (c’est-à-dire la production de bruit, les options de modification technique et les méthodes de mesure et de surveillance du bruit), b) des géosciences (c’est-à-dire les paramètres environnementaux qui affectent la propagation du son et la conception des programmes de surveillance et d’atténuation) et c) de la biologie et de l’écologie (c’est-à-dire les récepteurs des animaux, leur distribution, leur comportement et leur sensibilité aux impacts du bruit ; Fig. 3 ; 34). Des normes sont nécessaires pour la mesure et la surveillance du bruit et des réactions des animaux (par exemple, 35).
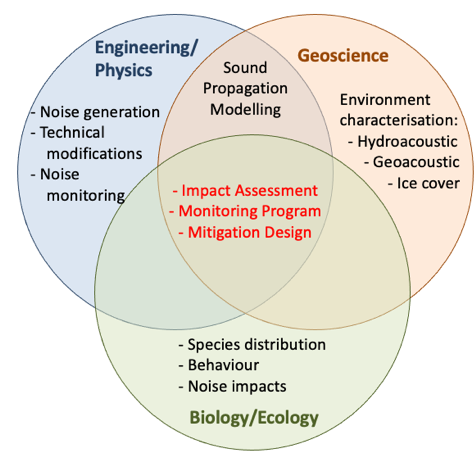
Figure 3. Diagramme des besoins de recherche et de gestion spécifiques à une discipline en ce qui concerne l’évaluation, la surveillance et l’atténuation des incidences du bruit.
La gestion du bruit exige en outre une approche internationale. Alors que les juridictions nationales individuelles ont leurs propres lignes directrices en matière de gestion du bruit (ou n’en ont aucune), une approche internationale cohérente est nécessaire, en particulier pour les animaux migrateurs qui traversent les juridictions et pour les régions à présence internationale, comme l’océan Austral.
- Les activités anthropiques dans l’océan Austral génèrent des bruits sous-marins : Les activités de recherche (y compris les navires et les études sismiques marines), le tourisme et la pêche.
- Le trafic maritime augmente d’année en année ; en particulier, le nombre de bateaux de tourisme est en forte hausse.
- Le bruit marin peut avoir un impact sur la micro et la mégafaune marine de l’Antarctique, du zooplancton aux baleines.
- Le bruit peut modifier le comportement des animaux, masquer leur communication, entraver leur perception de l’environnement, déplacer les animaux d’un habitat important pour eux, induire des réactions de stress, interférer avec leurs fonctions vitales (y compris l’alimentation et la reproduction), réduire la disponibilité des proies (en ayant un impact sur les espèces de proies), causer des blessures directes (en cas d’exposition extrême au bruit), et finalement affecter la survie.
- Très peu d’études sur les impacts du bruit ont été menées dans l’Antarctique et sur les espèces antarctiques, et la gestion du bruit est donc souvent basée sur des informations provenant d’espèces non antarctiques d’autres océans. La transférabilité des résultats doit être étudiée.
- Les effets des multiples facteurs de stress et leur interaction ne sont pas compris. Par exemple, le changement climatique rend-il les animaux plus ou moins sensibles aux effets du bruit ?
- Les méthodes d’évaluation du bruit sous-marin, d’atténuation de ses impacts potentiels et d’autorisation des activités anthropiques diffèrent selon les parties signataires du traité sur l’Antarctique et une approche plus unifiée est nécessaire.





