Ian Hawes (1)*, Anne D. Jungblut (2), Josef Elster (3), Bart Van de Vijver (4), Jill Mikucki (5)
Исследования внутренних вод Антарктики ведутся уже более ста лет. Биоразнообразие обеднено по сравнению с другими климатическими зонами и для большинства групп организмов уменьшается по мере удаления от Антарктического полуострова через прибрежные оазисы до континентальных пустынь. Многие группы организмов не смогли создать колонии или выжить в Антарктике, что позволило микробам преобладать во многих пищевых цепочках, особенно в высоких широтах. Современные методы молекулярной биологии способствуют выяснению структуры биоразнообразия среди плохо изученных сообществ антарктических микробов и вирусов. Подледниковая водная среда может представлять собой основную часть внутренних вод Антарктики, но она остаётся в значительной степени неизученной. Водная биота Антарктики включает в себя организмы и виды или штаммы, которые являются уникальными для всей Антарктики или её частей. Наибольшую угрозу представляют неместные виды как извне, так и из других частей континента. В существующих охраняемых районах находятся внутренние воды, представляющие большинство типов озёр, но в целом географический охват является редким и непредставительным с точки зрения текущих обозначений биорегионов.
Фототрофные первичные производители
Цианобактерии (сине-зелёные водоросли) представляют собой обильную фототрофную группу в Антарктике, часто образующую биоплёнки масштаба мм-см в пресных и солёных внутренних водах [3,6] (рис. 1). Эти толстые биоплёнки содержат множество других организмов, включая простейших и микробеспозвоночных[3,7,8]. Многие из этих матов эпизодически высыхают при подъёме и снижении уровня воды в озере, где граница между наземными и водными таксонами в Антарктике размыта. Качество воды, солёность и гидрология являются факторами, определяющими таксономическое распределение, хотя очевидно, что наиболее распространённые таксоны имеют широкие диапазоны роста в окружающей среде и широкие географические области распространения [7-9]. Группа цианобактерий Oscillatoriales, особенно виды Phormidium/Microcoleus и Leptolyngbya [9], отвечают за большую часть донной биомассы и первичную продукцию. Азотфиксирующие цианобактерии также широко распространены в озёрах и ручьях, в частности, Nostoc, Calothrix и Nodularia. По крайней мере, некоторые из этих доминирующих цианобактерий, образующих маты, по-видимому, являются биполярными [10], хотя другие потенциально эндемичны [9-13] и могли сохраняться в результате оледенения в свободных ото льда убежищах [5].

Рисунок 1. Бентические микробные маты, образованные цианобактериями на глубине 16 м в озере Бонни (справа – шкала 20 мм) и микрофотография Phormidium pseudopriestleyi (слева – шкала 10 мкм). Микробные маты имеют широкий спектр морфологий и характерны для антарктических озёр, прудов и ручьёв. (Изображения Anne Jungblut и Ian Hawes)

Рисунок 2. Сканирующая электронная микрофотография диатомовых водорослей (Luticola contii) из приморских антарктических озёр. Недавние исследования предполагают наличие более 50 различных таксонов и более высокую степень эндемизма, чем считалось ранее. (Изображение Bart Van de Vijver)
Диатомовые водоросли (рис. 2) распространены в пресноводных экосистемах Антарктики. К характерным родам относятся Luticola (12 таксонов), Psammothidium (4 таксона), Pinnularia, Navicula и Muelleria (3 таксона), а также Halamphora и Humidophila (2 таксона). Большинство таксонов являются эндемичными для Антарктического континента и имеют околополярное распределение, что согласуется с устойчивостью, обусловленной оледенением, а не недавней колонизацией, хотя из-за таксономической путаницы их региональные биогеографические характеристики остаются неопределёнными[14]. В соответствии с этой картиной устойчивости, обусловленной оледенением, в регионах прибрежных оазисов и Сухих долин Мак-Мёрдо отмечается относительно высокое разнообразие и эндемичность, при этом к числу типичных таксонов относятся Navicula shackletonii, Halamphora vyvermanii, Luticola gaussii и Muelleria peraustralis.
В фитопланктоне под ледяным покровом преобладают жгутиковые, хотя в свободных ото льда водах также присутствуют неподвижные хлорофиты, цианобактерии и иногда диатомовые водоросли. Динофлагелляты в изобилии присутствуют в некоторых солёных водах прибрежных оазисов и в озёрах Приморской Антарктики [3].
Нитчатые зелёные водоросли отличаются разнообразием и многочисленностью в озёрах и ручьях Приморской Антарктики, реже во внутренних континентальных водах. Пять морфологических видов Zygnemataceae в Приморской Антарктике сокращаются до одного в прибрежных оазисах и вовсе отсутствуют в Сухих долинах Мак-Мёрдо. Другие крупные зелёные водоросли относятся к околополярным видам, включая виды Binuclearia, Ulothrix, Klebsormidium и Prasiola. Один восточно-антарктический вид Prasiola (P. antarctica) и один западный (P. glacialis) были признаны в дополнение к широко распространённому P. crispa, но различаются только молекулярными методами [15].
Водные мхи присутствуют в озёрах и ручьях [16] и образуют важные места обитания для микроорганизмов (рис. 3). В западной Антарктике известны девять водных родов, а в восточной – четыре; и только Bryum pseudotriquetrum встречается в обоих регионах. Последний является единственным водным видом, проникшим в Сухие долины Мак-Мёрдо, где он обнаружен в одном озере. B. pseudotriquetum является земноводным видом, характерным для большинства водных видов. Исключением является вид Drepanocladus longifolius, распространённый на севере Приморской Антарктики, который также имеет центр распространения в Южной Америке [16].

Рисунок 3. Мхи (в основном Leptobryum sp.) образуют уникальные «столбы» в озёрах оазиса Сёва, поднимающиеся из простёртых микробных матов. Они включают в себя цианобактерии и разнообразные одноклеточные организмы, а также простые многоклеточные виды. (Изображение предоставлено Юкико Танабе, Национальный институт полярных исследований, Токио)
Фауна
Во всех внутренних водах Антарктики отсутствуют позвоночные и обитают разобщённые сообщества макробеспозвоночных [17]. Моллюски отсутствуют, а среда обитания единственного по-настоящему водного насекомого (Parochlus steinenii) ограничена Южными Шетландскими островами. В антарктических озёрах обитает по меньшей мере 19 видов ракообразных, в том числе планктонные и бентические пастухи (рис. 4), а также один хищный вид веслоногих ракообразных (Parabroteus sarsi, только в Приморской Антарктике). Судя по распространению, можно предположить, что некоторые из них являются давними обитателями Антарктики, возможно, после распада Гондваны, в то время как другие являются недавними колонистами из Южной Америки [17,18]. Разнообразие ракообразных снижается с девяти таксонов в Приморской Антарктике до семи в прибрежных оазисах (2 класса, включая два вида в солёных водах) и ограничивается всего 2 видами веслоногих в Сухих долинах Мак-Мёрдо [18]. В Антарктике присутствует, по крайней мере, четыре эндемичных пресноводных ракообразных, и все они отличаются локализованным распределением в прибрежных оазисах и Сухих долинах Мак-Мёрдо, где вновь предполагается устойчивость благодаря оледенениям в свободных ото льда убежищах [18].

Рисунок 4. Эпибентический жаброног (Branchinecta gaini) распространён в бассейнах и озёрах региона Антарктического полуострова (и Южной Америки). Его яйца в зимний период выдерживают температуру ниже -20oC. Яйца вылупляются под весенним ледяным покровом, чтобы летом завершить свой жизненный цикл. (Изображение предоставлено Антарктическим управлением Великобритании)
Микробеспозвоночные распространены как в донных сообществах озёр, так и в толще воды, в частности в сообществах простейших (инфузории и амёбы), коловраток, нематод, тихоходок (рис. 5) и плоских червей [3, 7, 8, 19, 20, 21].

Рисунок 5. Сканирующая электронная микрофотография тихоходки из микробного мата в регионе Сухих долин Мак-Мёрдо. Эти животные встречаются даже в экстремальных водных средах и занимают целый ряд трофических уровней. (Изображение Byron Adams)
Во многих системах они занимают верхнюю часть пищевых цепочек и могут накапливаться в больших количествах. Их таксономия сложна, с большим загадочным разнообразием, а области распространения, вероятно, не полностью изучены [20]. Разнообразие в этих группах, по-видимому, одинаково во всех регионах Антарктики, с небольшими признаками градиента видового богатства между севером и югом, хотя очевидна высокая степень различия между континентальными и морскими регионами [3]. Молекулярные подходы подтвердили наличие эндемичных таксонов, некоторые из которых являются панантарктическими, а другие, по-видимому, распределены по регионам [19-21].
Гетеротрофные и хемосинтетические прокариоты
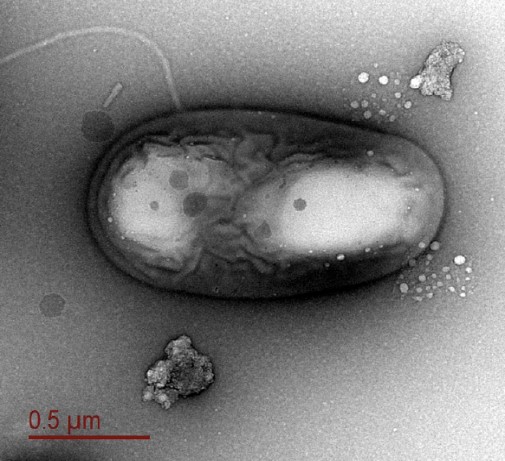
Рисунок 6. Электронная микрофотография бактерии из подледникового озера Уилланс. (Изображение Alicia Purcell)
Бактерии и археи являются, безусловно, ключевыми компонентами всех водных экосистем Антарктики и вместе с вирусами [22] вносят значительный вклад в биомассу на континенте. Действительно, вирусы в Антарктических озёрах очень динамичны и могут играть более важную роль в пищевых цепочках по сравнению с другими регионами [22]. Основываясь на растущем количестве молекулярных исследований с использованием методов секвенирования следующего поколения, различные микробные сообщества распределены по поверхностным водам Антарктики. Бактерии, ответственные за все основные питательные циклы, по-видимому, встречаются во всех водных экосистемах, где условия являются подходящими [23]. Например, прокариоты Антарктики в пресных и солёных озёрах и прудах являются связующим звеном для циклов азота, серы, железа и метана. В то время как функциональные сходства существуют во внутренних водах, даже географически близкие водоёмы, такие как озёра в Сухих долинах Мак-Мёрдо, имеют чёткое бактериальное разнообразие [24].
Разнообразные и обильные микробные таксоны были обнаружены в наиболее изолированных и плохо изученных внутренних водных водах континента: подледниковых экосистемах [25, 26] (рис. 6).
Имеющиеся ограниченные данные свидетельствуют о том, что подледниковая биота – это исключительно бактерии и археи; при этом были обнаружены различные метаболические группы. В отсутствие солнечного света эти системы получают первичную продукцию посредством хемосинтетических путей [25-27]. Изоляция подледниковой среды, возможно, привела к появлению локально различаемых микробиомов, однако проверка этой гипотезы зависит от доступа к большему количеству из сотен внутренних подледниковых антарктических водоёмов.
Сохранение и управление
Защита биоразнообразия внутренних водных объектов закреплена в Протоколе по охране окружающей среды к Договору об Антарктике, в частности, в Приложении II, которое требует минимального вмешательства в местные таксоны, охраны от инвазивных видов и предотвращения неблагоприятного воздействия на водную среду. Кодекс поведения при проведении исследований подледниковых озёр Антарктики был представлен на Консультативном совещании по Договору об Антарктике (КСДА) в 2011 году, а его обновлённая версия была одобрена Резолюцией, принятой Сторонами на КСДА в 2017 году. Особая охрана в виде статуса ОУРА и ООРА предоставляется некоторым районам, содержащим внутренние воды: ОУРА № 2 и 6 «Сухие долины Мак-Мёрдо» и «Холмы Ларсеманн, а также ООРА № 119 «Горы Пенсакола», ООРА № 126 «Полуостров Байерс», ООРА № 135 «Северо-восточная часть полуострова Бейли», ООРА № 136 «Полуостров Кларк», ООРА № 141 «Долина Юкидори», ООРА № 147 «Земля Александра I», ООРА № 165 «Мыс Эдмонсон» (рис. 7). На территории этих охраняемых районов находятся примеры многих различных типов озёр в приморской и континентальной Антарктике; хотя пресноводные системы потенциально недостаточно представлены в охраняемых районах Антарктики во всех антарктических биорегионах.
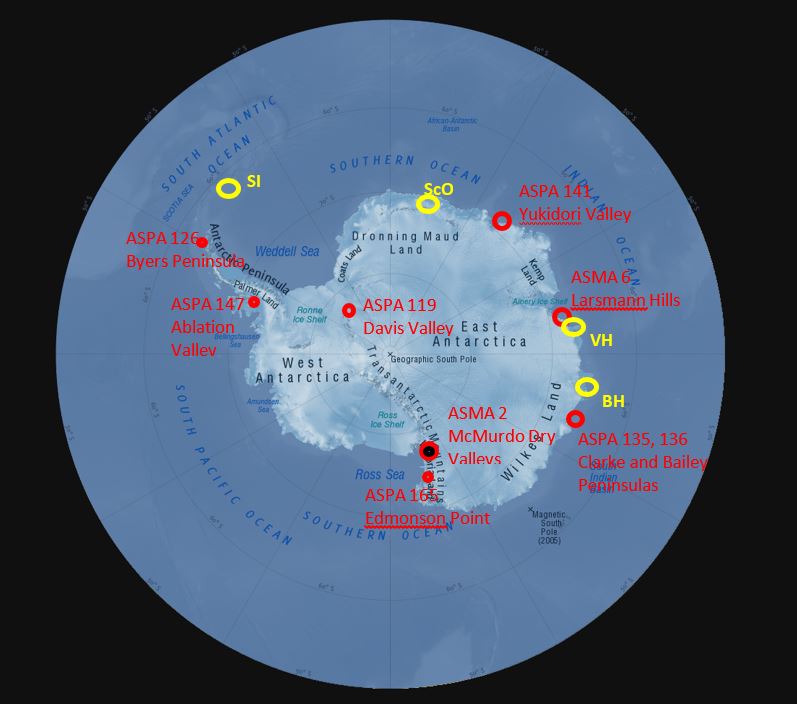
Рисунок 7. Расположение ОУРА и ООРА, содержащих значительные водные среды обитания в Антарктике. Другие известные основные места концентрации озёр: SI – остров Сигни; ScO – оазис Ширмахера; SyO – оазис Сёва; VH – холмы Вестфолд; BH – холмы Бангер.





