Ian Hawes (1)*, Anne D. Jungblut (2), Josef Elster (3), Bart Van de Vijver (4), Jill Mikucki (5)
Il existe, depuis plus de cent ans, des études sur les eaux intérieures en Antarctique. La diversité biologique s’appauvrit par rapport à d’autres zones climatiques et la plupart des groupes d’organismes sont en déclin de la péninsule antarctique aux déserts continentaux en passant par les oasis côtières. Un grand nombre d’entre eux ne sont pas parvenus à coloniser le milieu ou à survivre, permettant aux microbes de prédominer dans de nombreuses chaînes alimentaires, en particulier aux latitudes élevées. Les techniques de biologie moléculaire modernes pourraient apporter des réponses sur les caractéristiques de la biodiversité des communautés microbiennes et virales en Antarctique. Les environnements aquatiques sous-glaciaires pourraient représenter la grande majorité des eaux intérieures de ce continent, qui demeurent en grande partie inexplorées. Le biote aquatique de l’Antarctique comprend des organismes et des espèces ou des souches qui sont uniques sur l’ensemble, ou des parties, du territoire. Les espèces non indigènes, venant de l’extérieur ou d’une autre partie du continent, constituent la plus grande menace. Des zones protégées existantes contiennent des eaux intérieures, pour la plupart sous forme de lacs, mais la couverture géographique est clairsemée et non représentative dans l’ensemble, en ce qui concerne les désignations actuelles de biorégion.
Producteurs d’organismes phototrophes primaires
Les cyanobactéries (algues bleu-vert) représentent un groupe phytotrope abondant en Antarctique, formant souvent des biofilms à l’échelle du mm-cm dans des eaux intérieures douces et salines [3,6] (Fig. 1). Ces biofilms épais contiennent divers autres organismes, notamment des protistes et des micro-invertébrés [3,7,8]. Un grand nombre de ces tapis sèchent épisodiquement avec la hausse et la baisse des eaux des lacs, là où les taxons terrestres et aquatiques se confondent en Antarctique. La qualité de l’eau, la salinité et l’hydrologie sont des facteurs importants pour déterminer la distribution taxonomique, bien que la plupart des taxons communs semblent avoir un éventail large de croissance environnementale et des distributions géographiques étendues [7-9]. Le groupe de cyanobactéries Oscillatoriales, en particulier les espèces de Phormidiaceae/Microcoleus et Leptolyngbya [9], sont responsables de la plus grande partie de la production primaire et de la biomasse benthique. Les cyanobactéries qui fixent l’azote sont également largement répandues dans les lacs et les cours d’eau, en particulier Nostoc, Calothrix et Nodularia. Il semble que certaines de ces cyanobactéries dominantes qui forment des tapis soient bipolaires [10], mais d’autres sont potentiellement endémiques [9-13] et pourraient avoir survécu aux ères glaciaires dans des refuges libres de glace [5].

Figure 1. Les tapis microbiens benthiques formés par les cyanobactéries à 16 mètres de profondeur dans le lac Bonney (droite – barre d’échelle 20 mm) et une micrographie du Phormidium pseudopriestleyi (gauche – échelle 10 μm). Les tapis microbiens adoptent une grande variété de morphologies et sont propres aux lacs, étangs et cours d’eau de l’Antarctique. (Images Anne Jungblut et Ian Hawes)

Figure 2. Micrographie par balayage électronique de la diatomée (Luticola contii) de lacs de l’Antarctique maritime. Des études récentes suggèrent qu’il y aurait plus de 50 taxons différents et un degré plus élevé d’endémisme que préalablement envisagé. (Image Bart Van de Vijver)
Les diatomées (Fig. 2) sont abondantes dans les écosystèmes d’eau douce de l’Antarctique. Les genres typiques incluent : Luticola (12 taxons), Psammothidium (4 taxons) Pinnularia, Navicula et Muelleria (3 taxons), Halamphora et Humidophila (2 taxons). La plupart des taxons sont endémiques au continent antarctique et présentent une répartition circumpolaire, qui s’inscrit plus dans la théorie d’une persistance à travers les glaciations qu’une colonisation récente ; toutefois, en raison d’une confusion taxonomique, leur biogéographie régionale reste incertaine [14]. Concordant avec cette idée de persistance à travers les ères glaciaires, les régions de l’OC et de la VSM montrent une relativement grande diversité et endémicité, avec des taxons typiques dont Navicula shackletonii, Halamphora vyvermanii, Luticola gaussii et Muelleria peraustralis.
Les phytoplanctons sous la couche de glace sont dominés par des flagelles, mais l’on rencontre également dans les eaux libres de glace des chlorophytes non motiles, des cyanobactéries et occasionnellement des diatomées. Des dinoflagellés sont abondantes dans certaines eaux salines de l’OC et des lacs de l’AM [3].
Les algues vertes filamenteuses sont variées et abondantes dans les lacs et cours d’eau de l’AM, moins dans les eaux continentales. Il y a cinq morpho-espèces de Zygnématacées dans l’AM, puis une seule en OC et aucune dans les VSM. D’autres grandes algues vertes sont circumpolaires, notamment les espèces de Binuclearia, Ulothrix, Klebsormidium et Prasiola. Deux espèces de Prasiola , une (P. Antarctica) dans l’Antarctique oriental et une autre (P. glacialis) dans l’Antarctique occidentale ont été reconnues, en plus de la P. crispa, largement répandue, mais la distinction ne peut se faire qu’avec des techniques moléculaires [15].
Les mousses aquatiques sont présentes dans les lacs et les cours d’eau [16] et constituent un habitat important pour les microorganismes (Fig. 3). Neuf genres aquatiques sont connus dans l’Antarctique occidentale et quatre dans l’est ; seule la variété Bryum pseudotriquetrum se retrouve dans les deux zones. Cette espèce aquatique est la seule qui pénètre dans les VSM, où elle a été répertoriée dans un seul lac. B. pseudotriquetrum est une espèce amphibienne, ce qui est le cas de la plupart des variétés aquatiques. La Drepanocladus longifolius est une exception, commune dans le nord de l’AM, et dont le centre de répartition se trouve autrement en Amérique du Sud [16].

Figure 3. Les mousses (principalement la Leptobryum sp.) constituent des « piliers » uniques dans les lacs de l’oasis de Syowa, s’élevant d’une forme prostrée de tapis microbiens. Elles comprennent des cyanobactéries et une variété de prostites et de métazoaires simples. (Image reproduite avec l'autorisation de Yukiko Tanabe, Institut national de recherche polaire, Tokyo)
Faune
Toutes les eaux intérieures de l’Antarctique manquent d’espèces vertébrées et ont des communautés de macro-invertébrés appauvries [17]. Les mollusques sont absents et le seul insecte réellement aquatique (Parochlus steinenii) est confiné dans les îles Shetland du Sud. Au moins 19 espèces de crustacés occupent les lacs de l’Antarctique, notamment des brouteurs benthiques et planctoniques (Fig. 4) et un seul copépode prédateur (Parabroteus sarsi, AM uniquement). Les répartitions suggèrent que certains sont des résidents de longue date en Antarctique, potentiellement depuis la fragmentation du Gondwana, tandis que d’autres sont des colons récents d’Amérique du Sud [17, 18]. Concernant les crustacés, ils passent de neuf taxons dans l’AM à sept dans l’OC (2 classes, notamment des espèces salines) et seulement 2 copépodes dans les VSM [18]. L’Antarctique héberge au moins quatre espèces de crustacés endémiques d’eau douce, dont la répartition est localisée en OC et VSM, là où la persistance dans des refuges libre de glace à travers les ères glaciaires est suggérée [18].

Figure 4. L’énostracé épibenthique (Branchinecta gaini) est commun dans des bassins et lacs de la région de la péninsule antarctique (et en Amérique du Sud). Ses œufs qui hibernent tolèrent des températures en dessous de - 20º C. Ils éclosent sous la couche de glace du printemps afin de garantir qu’ils passent leur cycle de vie complet durant l’été. (Image de la BAS)
Les microinvertébrés sont courants dans les communautés des fonds des lacs et des colonnes d’eau, en particulier des protozoaires (ciliés et amibes), rotifères, nématodes, tardigrades (Fig. 5) et plathelminthes [3, 7, 8, 19, 20, 21].

Figure 5. Micrographie par balayage électronique d’un tardigrade à partir d’un tapis microbien dans la région des VSM. Ces animaux se trouvent même dans des habitats aquatiques extrêmes et occupent une gamme étendue de niveaux trophiques. (Image Byron Adams)
Dans de nombreux systèmes, ils sont en haut des réseaux trophiques et peuvent exister en très grand nombre. Leur taxinomie est complexe, la diversité est ardue à déchiffrer et les répartitions ne sont pas non plus entièrement comprises [20]. La diversité dans ces groupes semble être similaires dans toutes les régions de l’Antarctique, avec peu de preuves d’un gradient nord-sud de la richesse des espèces, bien qu’un haut degré de marques distinctives entre les régions continentales et maritimes est évident[3]. Les approches moléculaires ont confirmé la présence de taxons endémiques, dont certains sont pan-Antarctique et d’autres semblent répartis régionalement [19-21].
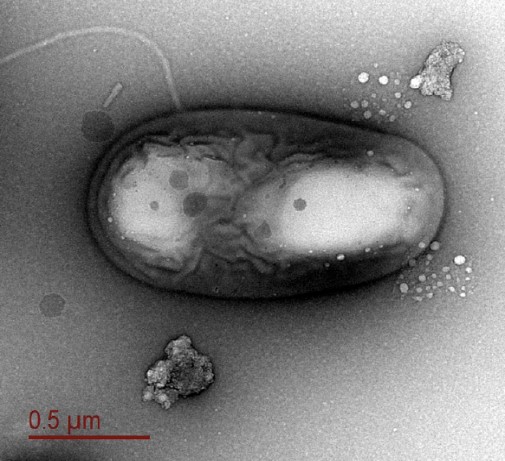
Figure 6. Une micrographie électronique d’une bactérie du lac sous-glaciaire Whillans. (Image Alicia Purcell)
Les bactéries et les archées sont, évidemment, des composants cruciaux de tous les écosystèmes aquatiques en Antarctique et, avec les virus [22], ils contribuent largement à la biomasse sur le continent. En effet, les virus sont extrêmement dynamiques dans les lacs de l’Antarctique et pourraient jouer un rôle plus important dans les réseaux trophiques que dans d’autres régions [22]. D’après un nombre croissant d’analyses moléculaires utilisant des techniques de séquençage de nouvelle génération, diverses communautés microbiennes sont réparties sur l’ensemble des eaux de surface de l’Antarctique. Les bactéries responsables de tous les grands cycles des nutriments semblent apparaître dans tous les écosystèmes aquatiques où les conditions sont adaptées [23]. Par exemple, les procaryotes de l’Antarctique dans les lacs et étangs d’eau douce et salins disséminent le cycle de l’azote, du souffre, du fer et du méthane. Tandis que des points communs existent dans les eaux intérieures, même des plans d’eau géographiquement proches , tels que les lacs des VSM, ont une diversité bactérienne distincte [24].
La présence de taxons microbiens abondants et variés a été détectée dans les eaux intérieures étudiées les plus isolées et les plus pauvres du continent : écosystèmes sous-glaciaires [25, 26] (Fig. 6).
Les données limitées disponibles suggèrent que le biote sous-glaciaire est exclusivement constitué de bactéries et d’archées et que divers groupes métaboliques ont été détectés. En l’absence de lumière du soleil, ces systèmes tire une production primaire via des réseaux chimiotrophes [25-27]. L’isolation des environnements sous-glaciaires peut avoir engendré des microbiomes localement différents, cependant pour tester cette hypothèse, il faudrait avoir accès à des centaines de systèmes d’eaux intérieures sous-glaciaires de l’Antarctique.
Conservation et gestion
La protection de la biodiversité des plans d’eau intérieurs est prévue dans le Protocole au traité sur l’Antarctique relatif à la protection de l’environnement, en particulier l’Annexe II qui prône le moins d’interférence possible avec les taxons indigènes, la protection contre les espèces envahissantes et la prévention contre les effets néfastes sur les environnements aquatiques. Un « code de conduite » pour l’exploration des lacs sous-glaciaires en Antarctique a été présenté lors de la Réunion consultative du Traité sur l’Antarctique de 2011 et une version actualisée a été adoptée par une résolution des Parties lors de la RTCA de 2017. Certaines zones contenant des eaux intérieures bénéficient de protection spécifique avec le statut de ZGSA et ZSPA ; les ZGSA 2 et 6 (les vallées sèches de McMurdo et les collines de Larsemann), et les ZSPA 119 (montagnes Pensacola), 126 (péninsule Byers), 135 (péninsule North-East Bailey), 136 (péninsule Clarke), 141 (vallée Yudikori), 147 (île Alexandre) 165 (pointe Edmonson) (Fig. 7). Ensemble, ces aires protégées contiennent de nombreux types de lacs différents, présents en Antarctique maritime et continentale ; cependant, les systèmes d’eau douce semblent potentiellement sous représentés dans les aires protégées de toutes les biorégions de l’Antarctique.
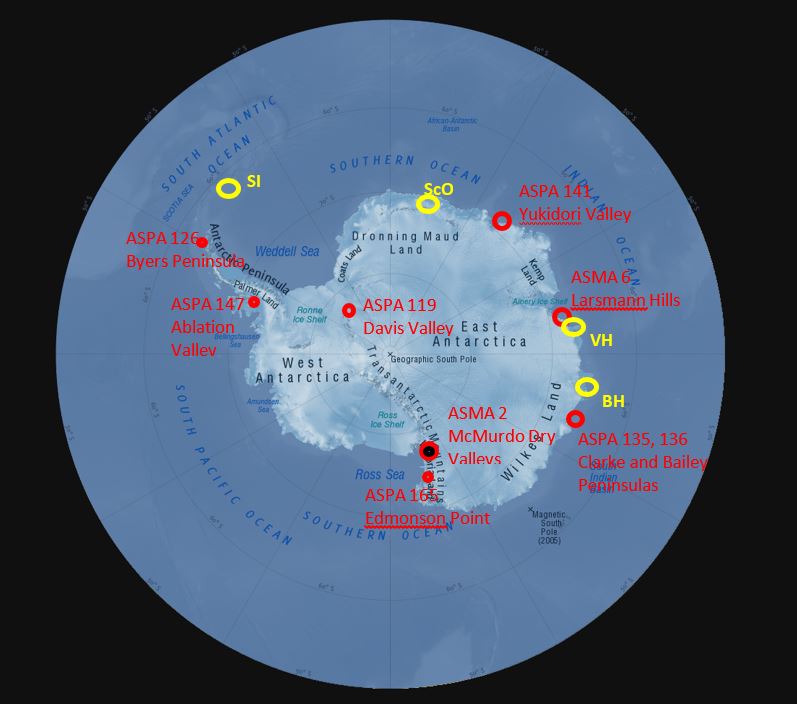
Figure 7. Emplacements des ZGSA et ZSPA contenant des habitats aquatiques importants en Antarctique. D’autres concentrations importantes connues de lacs : SI – île Signy ; ScO – oasis Schirmacher ; SyO – oasis Syowa ; VH – collines Vestfold ; BH – collines Bunger.





