Ian Hawes (1)*, Anne D. Jungblut (2), Josef Elster (3), Bart Van de Vijver (4), Jill Mikucki (5)
Durante más de un centenar de años se han llevado a cabo estudios sobre las aguas antárticas continentales. En comparación con otras zonas climáticas, la biodiversidad antártica es escasa y, para la mayoría de los grupos de organismos, esta disminuye a medida que pasa desde la península Antártica a los oasis costeros y, por último, a los desiertos continentales. Muchos grupos de organismos no han logrado colonizar la Antártida ni sobrevivir en ella, lo que ha permitido el predominio de los microbios en muchos de los entramados tróficos, en especial en aquellos que se encuentran a altas latitudes. Las modernas técnicas de biología molecular auguran la dilucidación de patrones de biodiversidad entre las escasamente comprendidas comunidades microbianas y virales antárticas. Es posible que, aunque los medios acuáticos subglaciares representen la mayor parte de las aguas antárticas continentales, estos se mantengan, en gran medida, sin explorar. La biota acuática antártica incluye organismos y especies o cepas que son exclusivas de toda la Antártida o de algunos sectores del continente. La mayor amenaza es la que plantean las especies no autóctonas que provienen ya sea de fuera del continente o de otros sectores de este. Las actuales zonas protegidas contienen aguas continentales que representan la mayoría de los tipos lacustres, pero su cobertura geográfica es escasa y en general poco representativa en términos de su actual designación como regiones biogeográficas.
Desde las primeras expediciones encabezadas por Scott y Shackleton [1,2] se ha investigado la biodiversidad acuática continental, pero los conocimientos siguen siendo fragmentarios, tanto en términos geográficos como taxonómicos. Los datos más completos provienen de tres regiones: la Antártida marítima (AM, que abarca la península Antártica y las islas asociadas), los oasis costeros de la Antártida Oriental (OC, que se consideran como el conjunto de regiones elevadas libres de hielo de la costa septentrional de la Antártida Oriental, entre 0 y 120o E y 65 y 70oS), y la región más austral de los valles Secos de McMurdo (VSM, centrada a 162oE, 77,5oS). Recientes estudios describen comunidades con menor diversidad de especies que las que están presentes en otras regiones del mundo, pero que contienen conjuntos que ofrecen todas las funciones necesarias para la formación de robustos entramados tróficos [3]. En su mayoría, contienen organismos que se encuentran únicamente en la Antártida [4], lo que representa una evolución con respecto al paradigma anterior de que existen pocas especies endémicas [5]. A la luz de los cambios que se prevén, es importante comprender la antigüedad, el origen y la distribución continental de la biota antártica para el desarrollo de un programa robusto de gestión de la biodiversidad.
Productores fototróficos primarios
Las cianobacterias (algas verde-azuladas) son un abundante grupo fototrófico en la Antártida que suele formar películas, de escalas que varían desde algunos milímetros hasta centímetros, en las aguas continentales dulces y salinas [3,6] (Fig. 1). Estas gruesas películas contienen una serie de otros organismos, entre los que se incluyen los protistas y los microinvertebrados [3,7,8]. Muchos de estos tapetes se secan de forma episódica en función del aumento o la disminución del agua lacustre en aquellos lugares de la Antártida donde son difusos los límites entre los taxones terrestres y acuáticos. La calidad del agua, y su salinidad e hidrología, son factores que determinan la distribución taxonómica, si bien, al parecer, los taxones más habituales tienen rangos de desarrollo medioambiental amplios y distribuciones geográficas extensas [7-9]. El grupo de cianobacterias Oscilatoriales, en particular las especies Phormidium / Microcoleus y Leptolyngbya [9], es el responsable de la mayor parte de la biomasa y la producción primaria bénticas. Las cianobacterias de fijación del nitrógeno están, también, ampliamente distribuidas en lagos y arroyos, en particular los géneros Nostoc, Calothrix y Nodularia. Al menos algunas de estas cianobacterias predominantes que forman tapetes parecen ser bipolares [10], si bien hay otras que posiblemente son endémicas [9-13] y que pueden haber persistido a través de las glaciaciones en refugios libres de hielo [5].

Figura 1. Tapices microbianos bénticos conformados por cianobacterias a 16 m de profundidad en el lago Bonney (a la derecha – barra de escala de 20 mm) y una micrografía del Phormidium pseudopriestleyi (a la izquierda – escala de 10 μm). Los tapices microbianos adoptan un amplio espectro de morfologías y son característicos de los lagos, lagunas y arroyos antárticos. (Imágenes de Anne Jungblut e Ian Hawes)

Figura 2. Micrografía por barrido electrónico de una diatomea (Luticola contii) proveniente de lagos de la Antártida marítima. Investigaciones recientes indican la existencia de más de 50 taxones distintos y un mayor grado de endemismo de lo que se pensaba. (Imagen de Bart Van de Vijver)
Las diatomeas (Fig. 2) son abundantes en todos los ecosistemas antárticos de agua dulce. Los géneros característicos incluyen Luticola (12 taxones), Psammothidium (4 taxones) Pinnularia, Navicula y Muelleria (3 taxones) y Halamphora y Humidophila (2 taxones). La mayoría de los taxones son endémicos del continente antártico y muestran una distribución circumpolar, acorde a la persistencia a través de las glaciaciones más que a una colonización reciente, no obstante, debido a algunas confusiones relativas a taxonomía, su biogeografía regional sigue siendo incierta [14]. De manera coherente con la imagen de la persistencia a través de las glaciaciones, las regiones de OC y de los VSM revelan una diversidad y endemismo relativamente más elevados, incluyéndose entre sus taxones típicos los géneros Navicula shackletonii, Halamphora vyvermanii, Luticola gaussii y Muelleria peraustralis.
En el fitoplancton bajo la capa de hielo hay predominio de flagelados, si bien en las aguas libres de hielo hay presencia, además, de cianobacterias y clorofitas no móviles, con la presencia ocasional, además, de diatomeas. En algunas aguas salinas de la región de OC y en lagos de la región de la AM abundan los dinoflagelados [3].
Las algas verdes filamentosas son diversas y abundantes en los lagos y arroyos de la región de la AM, si bien en menor grado en las aguas del interior continental. La presencia de cinco morfoespecies de Zygnemataceae en la región de la AM disminuye a la presencia de una en la región de OC y de ninguna en la región de los VSM. Las demás familias de algas verdes de gran tamaño son circumpolares e incluyen las especies de Binuclearia, Ulothrix, Klebsormidium y Prasiola. Se reconoció una especie de Prasiola (P. antarctica) de la Antártida Oriental y una de la Antártida Occidental, P. glacialis, además de la difundida P. crispa, si bien pueden distinguirse únicamente con el uso de técnicas moleculares [15].
En los lagos y arroyos hay presencia de musgos acuáticos [16] que constituyen importantes hábitats para los microorganismos (Fig. 3). En la Antártida Occidental se conocen nueve géneros acuáticos y en la Antártida Oriental se conocen cuatro, y tan solo el Bryum pseudotriquetrum se produce en ambas. Esta última es la única especie acuática que llega hasta la región de los VSM, cuya presencia se conoce en un único lago. La especie B. pseudotriquetum es una especie anfibia, lo cual ocurre con la mayor parte de las especies acuáticas. La Drepanocladus longifolius, común en la región de la AM septentrional, es una excepción que, de lo contrario, tendría su centro de distribución en Sudamérica [16].

Figura 3. Los musgos (en su mayoría de la especie Leptobryum) conforman singulares “pilares” en los lagos del oasis Syowa, los cuales surgen de tapetes microbianos postrados. Entre estos se incluyen cianobacterias y una diversidad de protistas y metazoos simples. (Imagen cortesía de Yukiko Tanabe, Instituto Nacional de Investigación Polar, Tokio)
Fauna
Hay ausencia de vertebrados en todas las aguas antárticas continentales, las que tienen en común la presencia de comunidades de macroinvertebrados de escasa abundancia[17]. No hay presencia de moluscos y el único insecto verdaderamente acuático (Parochlus steinenii) está confinado a las islas Shetland del sur. Los lagos antárticos están ocupados por al menos 19 especies de crustáceos, que incluyen herbívoros planctónicos y bénticos (Fig. 4) y un único copépodo depredador (Parabroteus sarsi, solamente en la región de la AM). Su distribución sugiere que algunos de ellos son residentes de larga data en la Antártida, posiblemente desde la disgregación de Gondwana, en tanto que otros son colonizadores llegados hace poco tiempo desde Sudamérica [17, 18]. La diversidad de los crustáceos disminuye desde nueve taxones en la región de la AM hasta siete en la región de OC (2 clases que incluyen dos especies salinas) y llega a apenas 2 copépodos en la región de los VSM [18]. En la Antártida hay por lo menos cuatro crustáceos de agua dulce endémicos, todos con distribución localizada en las regiones de OC y VSM, lo que, una vez más, es indicio de su persistencia a través de las glaciaciones en refugios libre de hielo [18].

Figura 4. Es habitual encontrar al camarón duende epibéntico (Branchinecta gaini) en estanques y lagos de la región de la península Antártica (así como en Sudamérica). Sus huevos con capacidad de tolerar el invierno toleran temperaturas bajo los -20 oC. Los huevos eclosionan bajo la cubierta de hielo primaveral, lo que garantiza que su ciclo biológico pueda completarse durante el verano.
Es habitual encontrar microinvertebrados tanto en las comunidades presentes en lechos lacustres como en la columna de agua, en particular protozoos (ciliados y amebas), rotíferos, nematodos, tardígrados (Fig. 5) y platelmintos [3, 7, 8, 19, 20, 21].

Figura 5. Micrografía por barrido electrónico de un tardígrado de un tapete microbiano, en la región de los VSM. Estos animales se encuentran incluso en hábitats acuáticos extremos y ocupan un espectro de niveles tróficos. (Imagen de Byron Adams)
Estos ocupan los niveles tróficos superiores en muchos sistemas y pueden acumularse en grandes cantidades. Su taxonomía es compleja, con un alto grado de diversidad críptica, y es probable que su distribución no se haya comprendido cabalmente [20]. En estos grupos, la diversidad pareciera ser similar en todas las regiones antárticas y hay escasa evidencia de una gradiente norte – sur en términos de abundancia, si bien es evidente un alto grado de diferenciación entre las regiones continental y marítima [3]. Las metodologías moleculares confirman la presencia de taxones endémicos, entre los cuales algunos son panantárticos y otros parecen tener distribución local [19-21].
Organismos procariotas heterotrofos quimiosintéticos
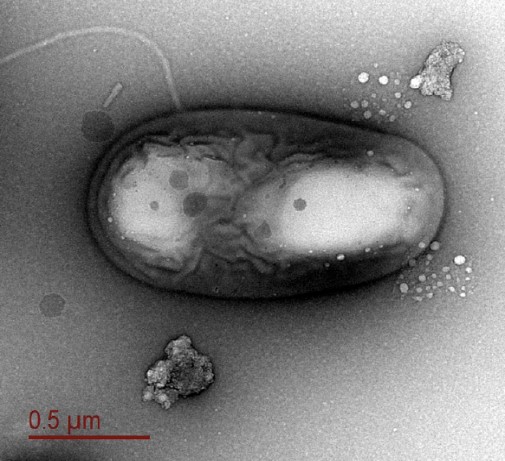
Figura 6. Micrografía electrónica de una bacteria del lago subglaciar Willans. (Imagen de Alicia Purcell)
Las bacterias y arqueas son, por cierto, los componentes clave de todos los ecosistemas acuáticos antárticos y, junto con los virus [22], contribuyen de manera importante a la biomasa del continente. En realidad, los virus son altamente dinámicos en los lagos antárticos y es posible que desempeñen una función más importante que en otras regiones [22] en los entramados tróficos. Con base en una cantidad en aumento de estudios moleculares con uso de tecnologías de secuenciación de última generación, se comprobó que las diversas comunidades microbianas se distribuyen en las aguas de superficie de toda la Antártida. Al parecer, las bacterias responsables de todos los principales ciclos de nutrientes se producen en todos los ecosistemas acuáticos en los que se dan las condiciones adecuadas [23]. Por ejemplo, los organismos procariotas antárticos presentes en lagos y lagunas de agua dulce y agua salina son mediadores de los ciclos del nitrógeno, el sulfuro, el hierro y el metano. Si bien existen semejanzas funcionales en las aguas continentales, incluso en cuerpos de agua cercanos en términos geográficos, tales como los lagos de la región de los VSM, la diversidad bacteriana que contienen es disímil [24].
Se detectaron taxones microbianos diversos y abundantes en las aguas continentales más aisladas y menos estudiadas del continente: los ecosistemas subglaciares [25, 26] (Fig. 6).
Los limitados datos con que se cuenta sugieren que la biota subglaciar está compuesta exclusivamente por bacterias y arqueas, y se detectaron diversos grupos metabólicos. En ausencia de luz solar, estos sistemas derivan su producción primaria por medio de vías quimiosintéticas [25-27]. Es posible que el aislamiento de los medioambientes subglaciares haya tenido como resultado la formación de microbiomas distintos a nivel local, sin embargo, la comprobación de este fenómeno depende del acceso a varios centenares de cuerpos de agua continentales subglaciares.
Conservación y gestión
En el Protocolo al Tratado Antártico sobre Protección del Medio Ambiente se consagra la protección de la biodiversidad de los cuerpos de agua continentales, lo que se expresa, en particular, en el Anexo II, que impone los requisitos de una interferencia mínima con los taxones endémicos, su protección ante las especies invasivas y evitar los impactos adversos sobre los medios acuáticos. Durante la Reunión Consultiva del Tratado Antártico (RCTA) de 2011, se presentó un “código de conducta” sobre la exploración de lagos subglaciares antárticos, cuya versión actualizada y refrendada por las Partes por medio de una Resolución se presentó en ocasión de la RCTA de 2017. Se confiere protección específica por medio de su designación como ZAEA y ZAEP a algunas zonas que contienen aguas continentales; las ZAEA n.° 2 y n.° 6 (valles Secos de McMurdo y colinas de Larsemann, respectivamente), y a las ZAEP n.° 119 (montañas Pensacola) n.° 126 (península Byers), n.° 135 (noreste de la Península Bailey), n.° 136 (península Clarke), n.° 141 (valle Yudikori), n.° 147 (isla Alexander) y n.° 165 (punta Edmonson) (Fig. 7). En su conjunto, estas zonas protegidas contienen ejemplos de muchos de los diferentes tipos lacustres que se encuentran en la Antártida marítima y continental, si bien es posible que los sistemas de agua dulce estén insuficientemente representados en las zonas protegidas de la Antártida en todas las bioregiones antárticas.
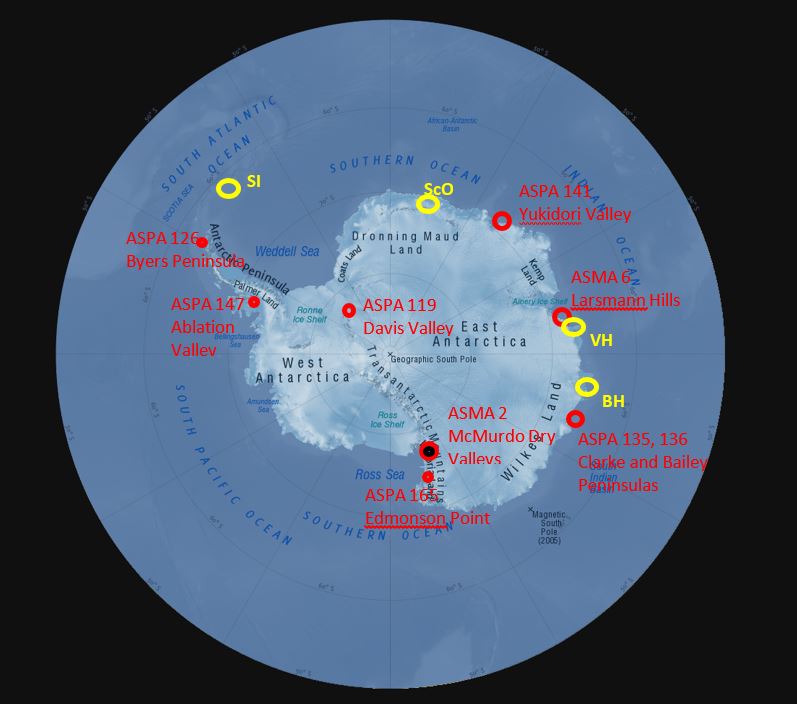
Figura 7. Ubicación de ZAEA y ZAEP que contienen hábitats acuáticos importantes en la Antártida. Otras concentraciones importantes de lagos son las siguientes: IS – isla Signy; OSc – oasis Schirmacher; OSy - Oasis Syowa; CV – cerros Vestfold; CB - cerros Bunger.





