Marthán N. Bester(1), Horst Bornemann(2), Gustavo A. Daneri(3), John van den Hoff(4)
- Mammal Research Institute, Department of Zoology and Entomology, University of Pretoria, South Africa
- Alfred-Wegener-Institut, Helmholtz-Zentrum für Polar- und Meeresforschung, Bremerhaven, Germany
- División Mastozoología, Museo Argentino de Ciencias Naturales “Bernardino Rivadavia” CONICET, Argentina
- Australian Antarctic Division, Tasmania, Australia
- Несмотря на массовое истребление южных морских слонов в целях коммерческой добычи подкожного жира в середине и конце XIX века, их популяции сохранились практически во всех исторических местах размножения.
- В настоящее время количество южных морских слонов в Южном ледовитом океане оценивается в 749 000 особей, около 2% (14 500) из которых проживает в регионе действия Договора об Антарктике, к югу от 60º южной широты.
- Несмотря на то, что эти наиболее удаленные к югу постоянные размножающиеся популяции являются весьма малочисленными, большая (нуждающаяся в дальнейшем уточнении) доля особей, происходящих из основных субантарктических мест размножения, проводит 70–80% своего времени в море к югу от 60º южной широты, питаясь различными видами добычи над континентальным шельфом Антарктики, а также вблизи кромки морского льда. Обе указанные области чувствительны к изменению климата
- Южные морские слоны питаются различными видами потенциальной и реализуемой промысловой рыбы и кальмаров. В связи с тем, что эти животные ныряют на глубину до 1000–1200 метров, они подвергаются риску случайного взаимодействия, часто — со смертельным исходом (до 90% случаев), с операциями по коммерческому отлову рыбы, в частности при ярусном отлове нототениевых (разновидности Dissostichus).
- Необходимо также установить взаимосвязь между южными морскими слонами и отловом криля (Euphausia superba), обитающего в регионе действия Договора об Антарктике.
- Остается в значительной степени неизвестным и неопределенным, каким образом популяции морских слонов будут реагировать по отдельности и кумулятивно на последствия изменения климата и будущего потенциального увеличения объемов коммерческого изъятия пищи из мест их кормления.
Распределение и численность особей
Значительно сократившиеся популяции южных морских слонов Mirounga leonina восстановили численность с принятием охранных мер после массового отлова с целью добычи подкожного жира в середине и конце XIX века. Их число вновь уменьшилось в период с 1950-х по 1990-е годы по неизвестным причинам с последующей стабилизацией, а в некоторых местах популяции увеличились. Популяции южных морских слонов, совместно насчитывающие около 749 000 особей1, включают в себя как минимум четыре генетически различных популяции по всему ареалу Южного океана2. Две из них обитают в южной части Атлантического океана, одна — в южной части Индийского океана, а четвертая — в южной части Тихого океана. В то время как основные размножающиеся популяции обитают в северной части региона действия Договора об Антарктике (далее «Регион»), более мелкие размножающиеся популяции обитают в основном на островах в районе Антарктического полуострова, входящего в Регион (рис. 1). В настоящее время около 14 500 особей, ~ 2% от всей популяции южных морских слонов, проводят круглый год в пределах Региона.
Так как в октябре прибрежные районы Антарктики недоступны из-за морского льда, щенение на континенте случается редко3,4. Тем не менее, установлено, что небольшие популяции размером от 20 до 500 особей, состоящие в основном из самцов разного возраста, прибывают на свободные ото льда участки Антарктического континента (рис. 1) для ежегодной линьки (с января по апрель). В этот период летний ледяной покров минимален по толщине и позволяет выйти на берег. Из-за удаленности некоторых из таких мест линьки бывает достаточно сложно отслеживать количество животных в популяциях. Однако там, где люди ведут свою деятельность вблизи от мест линьки, было установлено, что из года в год численность меняется (неопубликованные данные ван ден Хоффа).
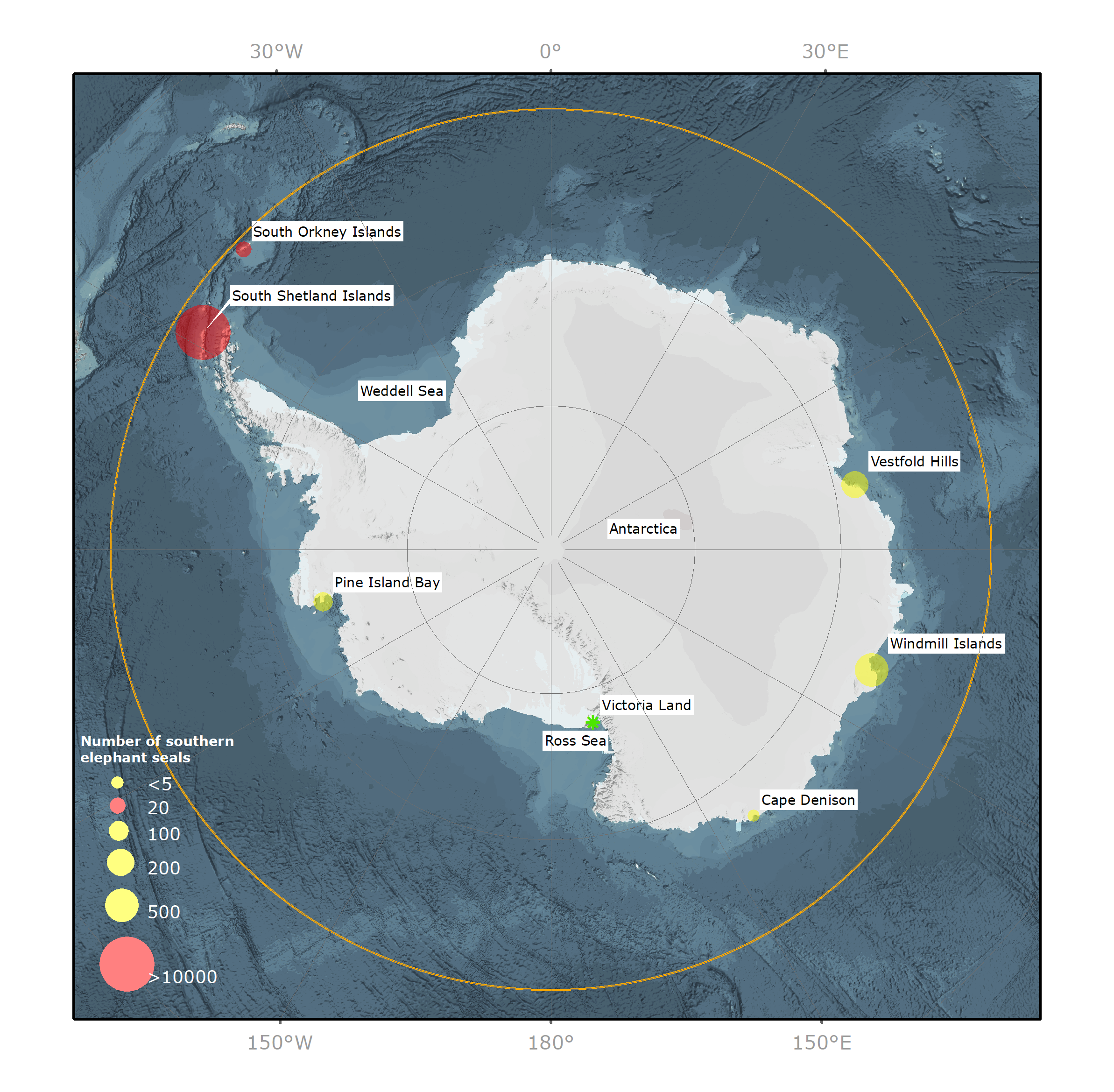
Рисунок 1. Изображение Антарктики и Южного океана, показывающее распределение и численность южных морских слонов (Mirounga leonina) в местах размножения (красная точка) и линьки (желтая точка). Оранжевая линия = северная граница Района действия Договора об Антарктике на широте 60º ю. ш. Зеленая звездочка = предыдущее место размножения.
Что касается естественной регуляции численности популяций данного вида, известно немного, в особенности о популяциях, проживающих в Регионе. Истребление косатками (Orcinus orca) в субантарктическом регионе является фактором, влияющим на количество животных, особенно это касается небольших размножающихся популяций5. Раны от укусов, наблюдаемые на выживших особях, свидетельствуют о том, что на морских слонов также нападают полярные акулы (Somniosus antarcticus) и другие виды акул, однако не все попытки охоты являются успешными6.
Существуют свидетельства того, что изменчивость климата может иметь последствия для численности самок южных морских слонов, размножающихся на острове Маккуори7. Потенциал влияния климата на популяции южных морских слонов имеет значение для их регуляции в связи с будущими изменениями климата планеты. Тем не менее, после долгих исследований причины наблюдаемых на сегодняшний день долгосрочных тенденций в популяциях южных морских слонов остаются неясными, также остается неустановленной их восприимчивость к изменению климата. Другие виды воздействий на популяции, такие как антропогенное, гораздо более очевидны, поскольку они связаны с коммерческим рыболовством. Наблюдается случайная гибель особей, связанная с установленным коммерческим ловом и рыбопромысловой разведкой нототениевых (разновидности Dissostichus) ярусными снастями8,9(рис. 2). Необходимо более детально изучить взаимодействие между тюленями, нототениевыми видами рыбы и ловом криля (E. superba) в Регионе.

Рисунок 2. Южные морские слоны (Mirounga leonina) иногда становятся «случайным приловом» при ярусном лове нототениевых (виды Dissostichus). Данные о такой случайной смертности, связанной с промысловой деятельностью, собираются научными наблюдателями и ежегодно публикуются АНТКОМ. (например, https://www.ccamlr.org/en/wg-fsa-2019/16-rev-2). Гибель тюленей обычно происходит в результате утопления во время замачивания яруса. Этот молодой тюлень зацепился за крюк пастью, запутался в ярусе и, вероятно, утонул на глубине ~ 950 м. Несоответствие в отчетах по разным промыслам, а также неизвестные уровни распространенности незаконного рыболовства затрудняют определение того, сколько южных морских слонов погибает каждый год в ходе промысловых операций в Южном океане. Фото: имя не разглашается по коммерческим причинам.
Хотя южные морские слоны проводят более 85% жизни питаясь в море, они выходят на сушу в районе Антарктического полуострова дважды в год, будучи взрослыми особями: один раз для размножения, начиная с конца сентября до начала ноября (весна в Южном полушарии), и один раз для ежегодной линьки с декабря по март (лето в Южном полушарии). Не принимающие участия в процессе размножения более молодые возрастные группы также выходят на берег дважды в год. Молодь начинает линьку уже в ноябре и может ненадолго появляться на суше в середине года на период, называемый серединой зимней лежки.
Предпочтительной средой обитания для линьки южных морских слонов в свободных ото льда районах на континенте и на островах в пределах Региона10 (рис. 2) являются пологие песчаные пляжи, обеспечивающие доступ к местам общего пользования, известным как территории для линьки. Такое предпочтение в выборе среды обитания часто приводит к пересечению с деятельностью человека, связанной с ней инфраструктурой и операциями (рис. 3).

Рисунок 3. Вид на север с холмов Вестфолд в Восточной Антарктике, в сторону наступающей кромки зимнего морского льда. После завершения ежегодной линьки на суше эти самцы южных морских слонов (Mirounga leonina) должны пересечь лед, чтобы добраться до зимних мест кормления. Обратите внимание на близость инфраструктуры станции (пристань и контейнеры) к пляжу, где линяли тюлени. Фото: Рэйчел МакАйнерни
Холодная и сухая среда Антарктики в сочетании с многократным использованием некоторых участков для линьки способствуют сохранению и накоплению сброшенной шерсти. Исследования таких постоянно используемых территорий для линьки в холмах Вестфолд показали (неопубликованные данные ван ден Хоффа), что за несколько тысяч лет слой сброшенной шерсти вырос до толщины 90 см (рис. 4).

Рисунок 4. Часть обширной территории для линьки южных морских слонов в холмах Вестфолд в Восточной Антарктике. Обратите внимание на слоистое отложение шерсти и фекалий, которое в данном случае имеет глубину около 70 см. Открытая вода с февраля до начала апреля позволяет тюленям проникать в этот район. Масштаб в см.
Самки южного морского слона вырастают до 2,8 м в длину и могут весить до 900 кг. Взрослые самцы значительно крупнее, достигая 5 м в длину и до 5000 кг веса. Самки могут жить более 23 лет и становятся половозрелыми в возрасте около 2–6 лет. Самцы становятся способными к размножению в возрасте 4–5 лет, а зрелыми социально в 6–8 лет, однако большинство самцов размножается в возрасте 9–12 лет. Самки в возрасте от 3 до 23 и более лет рожают одного щенка в период с конца сентября по начало ноября. Обычно это происходит в группах из двух и более самок, называемых «гаремами»11 (рис. 1) Щенки кормятся молоком около 3 недель, до конца ноября; данный процесс обычно происходит позже в более высоких широтах Региона, где пик лежбища самок приходится примерно на 11 дней позже, чем в субантарктических широтах12. Незадолго до отъема детенышей взрослые самки спариваются на суше с доминантными самцами (секачами). Менее доминантные самцы (дополнительные секачи) имеют возможность спаривания в гаремах, численность которых обычно превышает 60 самок. После сезона размножения все принимавшие участие взрослые особи отправляются в море13.
Популяции Региона, проживающие в районе Антарктического полуострова, отличаются самыми крупными щенками в период отъема14 и самыми крупными самками среди всех популяций. Данные исследования показали, что высокая доступность пищи в этом районе способствовала чрезмерному размеру тела самок, что положительно повлияло на их детенышей в период лактации.
Как продолжительность, так и глубина ныряния южных морских слонов различается в зависимости от пола, возрастной группы и региона. Взрослые морские слоны, обитающие в районе Антарктического полуострова, выполняют продолжительные и глубокие нырки. Самки ныряют на среднюю глубину (± стандартное отклонение) в 368 (± 83) м, тем не менее, средняя максимальная глубина составляет 1099 (± 400) м. Наиболее глубокий зарегистрированный нырок самки данного вида составил 2378 м. В среднем, нырок продолжается 24,6 (± 5,6) минут, средняя максимальная продолжительность составляет 67,0 (± 18,2) минут, абсолютный максимум — 92,3 минуты. Взрослые самцы ныряют на среднюю глубину в 399 (± 49) м, средняя максимальная глубина составляет 1275 (± 282) м. Наиболее глубокий зарегистрированный нырок самца в данном регионе достиг глубины в 1629 м. Средняя продолжительность таких нырков составляет 24,5 (± 3,8) минут, средний максимум — 70,6 (± 9,9) минут, абсолютный максимум — 82,3 минуты1. На основании этой информации можно предположить, что южные морские слоны способны передвигаться под водой на расстояние до 5 км в течение примерно полутора часов.
Как правило, морские слоны в Регионе ныряют глубоко и кормятся в основном в средних (мезопелагических) областях водной толщи. Продолжительные нырки чередуются с короткими интервалами на поверхности длительностью примерно в 2–3 минуты. Животные демонстрируют суточную схему ныряния: они ныряют на меньшие глубины ночью/в сумерках и на большие глубины днем. Эти схемы ныряния, вероятно, обусловлены вертикальным перемещением добычи11.
Экология кормодобывания южных морских слонов имеет тенденцию коррелировать с рядом физических океанографических свойств, в частности — с концентрацией морского ледяного покрова и температурой воды. В конце весны и в начале лета16 температура воды, уровни поверхностного освещения и процент поверхностного света, достигающего глубины 150 м, также влияют на поиск пищи животными в дневное, ночное и сумеречное время на глубинах кормления. Однако в этих взаимоотношениях прослеживаются также межпопуляционные, межсезонные, широтные и половые различия1,16.
Установление полного набора видов добычи, потребляемых морскими слонами во время их обширных миграций по океану, сопряжено со многими проблемами. В основном, морские слоны кормятся обитающими на глубине видами рыб и кальмаров, однако немного информации доступно о том, где животные поедают добычу. Содержимое желудка взрослой самки, обитающей в пределах Региона, включало в себя головоногих моллюсков, в частности, антарктического ледникового кальмара Psychroteuthis glacialis и другие мускулистые виды, такие как Alluroteuthis antarcticus и Moroteuthis knipovitchi, в качестве основной добычи, за которой следовала рыба. В основном, рыба была представлена мезопелагическими светящимися анчоусами, такими как Gymnoscopelus nicholsi и Electrona antarctica, включая антарктическую серебрянку Pleuragramma antarctica в более высоких широтах. Самцы южных морских слонов потребляют тот же набор видов кальмаров, что и самки, но самцы также больше питаются придонными осьминогами Pareledone17,18. В дополнение к головоногим моллюскам и рыбе эвфаузиидные ракообразные, наиболее вероятно, виды Euphausia (криль) могут представлять собой важную сезонную добычу, в особенности для молоди19,20.
Рацион морских слонов был составлен на основе анализа жирных кислот и стабильных изотопов азота и углерода, которые накапливаются в частях тела в результате потребления. В целом, эти исследования подтвердили данные, полученные при изучении содержимого желудка, демонстрируя, что южные морские слоны являются хищниками, питающимися как рыбой, так и кальмарами, а некоторая молодь может охотиться также на рачков-эуфазиидов20. Более того, исследования данного типа также показали, что пропорциональное соотношение этих широких групп добычи (рыба/кальмары/смешанные) может варьироваться как во времени, так и территориально20,21.
Что касается временных интервалов, южные морские слоны перемещаются предсказуемо: существует пелагический период после размножения, длящийся около 2–3 месяцев у взрослых самок (примерно с конца октября по январь) и около 4–6 месяцев у взрослых самцов, после чего они возвращаются на сушу для ежегодной линьки. После периода линьки на суше следует очередной период в море, а затем тюлени возвращаются на сушу для размножения. Что касается пространственного аспекта, среднее расстояние перемещения (+ стандартное отклонение) животных для размножения/линьки в Регионе в окрестностях Антарктического полуострова достигает 1464 + 767 км (макс. 3547 км) и 1270 + 1105 км (макс. 3133 км) для взрослых самок и самцов соответственно1. Большинство остается на шельфе западной части Антарктического полуострова или вблизи него, хотя некоторые тюлени совершают очень длительные миграции на запад вдоль кромки льда, пересекаясь с тюленями из популяции о-ва Маккуори22. Эти цифры варьируются между популяциями и в зависимости от глубины в районах их кормления, а также от того, какой тип ныряния используют животные (пелагический или бентический)23,24. В пределах региона Антарктического полуострова морские слоны сезонно используют пограничную зону морского льда и районы повышенной продуктивности у кромки льда, но могут также выходить на толстый дрейфующий лед, включая высокие концентрации морского льда над склоном континентального шельфа внутренней части моря Уэдделла25, 26, 27.
Южные морские слоны, часто встречающиеся в покрытых льдом районах, обычно прибывают из размножающихся колоний в высоких широтах, таких как местность в окрестностях Антарктического полуострова, а также с островов, расположенных к северу от Региона1. Тюлени из южных частей Индийского и Тихого океанов обычно быстро перемещаются на юг в воды Антарктики с последующим извилистым передвижением либо в относительно ограниченных, сезонно покрытых льдом шельфовых водах вдоль восточно-антарктического побережья (частично в зависимости от полыней), либо в дрейфующих льдах в северной части моря Росса.
В настоящее время (2020 г.) южные морские слоны занесены в Красный список Международного союза охраны природы (МСОП) как «вид, вызывающий наименьшее беспокойство». Кроме того, южные морские слоны указаны в Приложении II к Конвенции о международной торговле видами дикой фауны и флоры, находящимися под угрозой исчезновения (СИТЕС). В пределах Региона южные морские слоны имеют охранный статус в соответствии с Конвенцией о сохранении тюленей Антарктики (КОТА). Протокол по охране окружающей среды к Договору об Антарктике (Мадридский протокол) применяет общие меры защиты к местной фауне и флоре. Конвенция о сохранении морских живых ресурсов Антарктики (Конвенция АНТКОМ) учитывает все виды тюленей в качестве элементов экосистемы Южного океана, что включает рассмотрение воздействия промысловых операций на районы кормления тюленей и их добычу. Конвенция АНТКОМ применяет усиленные меры по сокращению случайного прилова тюленей и птиц, но эти меры не исключают некоторого уровня смертности таких видов как в пределах Региона9, так и за его пределами (рис. 3).
Наш текущий уровень знаний показывает, что человек влияет на морских слонов напрямую, вторгаясь на их территорию и вызывая случайную гибель, а также косвенно — изменяя морские экосистемы, что может быть связано с глобальными климатическими тенденциями. Причины предыдущих и нынешних изменений в численности южных морских слонов остаются неясными. Тем не менее, вероятно, что они стали результатом изменений в среде обитания и экосистеме, связанных с климатом2, с морской экосистемой и опосредованных, прежде всего, изменениями в распределении и численности добычи28. Важно отметить, что наблюдаемые изменения в численности морских слонов совпадают с наблюдаемыми или прогнозируемыми изменениями численности других высших хищников в районе Антарктического полуострова в ответ на изменения климата29. Тем не менее, существует значительная неопределенность в отношении того, как данный вид фактически отреагирует на природные и антропогенные нагрузки в Южном океане30, который может продолжить претерпевать существенные изменения, связанные с потеплением водных масс, усилением западных ветров, сдвигом полюсов в фронтальных системах океана, а также с отступлением морского и шельфового льда в некоторых регионах31.
Одной из исследовательских задач будет сбор исчерпывающей информации для понимания схем кормодобывания южных морских слонов в пределах Региона. Продолжительные (10 и более лет) и прямые наблюдения потребляемой добычи в данный момент осуществляются с помощью систем видеонаблюдения, закрепленных на животных. Такая информация будет способствовать получению ценных знаний о потребляемых видах добычи, о пересечении вида с промысловой деятельностью, об изменениях частоты видов добычи во времени и связанных с ними изменениях в стратегиях кормления, которые могут позволить этому виду адаптироваться к изменениям в ресурсах добычи на территории всего Региона. Также, такие исследования позволят более детально понять наблюдаемую высокую трофическую специализацию среди отдельных тюленей, которая потенциально может ограничивать эту адаптацию32.
Были собраны демографические и морфометрические данные о южных морских слонах из широкого диапазона популяций, в том числе в пределах Региона. Было бы полезным возобновить аналогичные исследования, направленные на сбор сопоставимых данных, чтобы проверить, как связанные с климатом изменения среды обитания могли повлиять на эти популяции. Например, в 1997 г. масса щенков в момент прекращения питания молоком была значительно выше у животных, обитавших у Антарктического полуострова, чем в других местах. Вероятно, это связано с локальным изобилием пищи в данном регионе. Так ли это до сих пор? Здесь основной задачей будет координация таких исследований в разных популяциях и в разные годы.
Ожидается, что в пределах Региона изменения климата принесут пользу южным морским слонам за счет создания дополнительных незамерзающих пляжей, подходящих для наземных видов деятельности животных, таких как линька и размножение34. К тому же, выводы, основанные на генетических данных, дают основания полагать, что ныне исчезнувшая размножающаяся популяция, существовавшая в море Росса, на побережье Земли Виктории (рис. 1), возникла , затем возросла в численности с отступлением льда примерно за 8000 лет до настоящего времени, а затем прекратила свое существование, когда лед вновь вернулся приблизительно за 1000 лет до настоящего времени35. В настоящее время предполагается увеличение размера популяции36, 37 в районе Антарктического полуострова, однако из-за протяженности морского льда, который блокирует доступ к пляжам в октябре, в период размножения, места размножения в континентальной Антарктике остаются крайне малочисленными. Кроме того, немного известно об изменениях в неразмножающейся (линяющей) популяции и о том, могут ли какие-либо изменения быть связаны с изменениями в основных субантарктических популяциях морских слонов, которые выступают в качестве исходных популяций для Региона. Для ответа на данные вопросы требуется более детальное наблюдение за популяциями и исследование потенциальных мест их обитания в пределах Региона, а также изучение субантарктических исходных популяций.
Явные преимущества также представляет интеграция биологических данных с сопутствующими данными физической океанографии in situ, которые могут быть использованы для изучения поведения тюленей и его влияния на динамику популяции1. Такое структурирование данных следует поощрять, так как это позволит измерить количественно, как изменения в окружающей среде, в пределах года и с течением лет, влияют на поведение животных, а также как это может отразиться на темпах роста популяций1. В настоящее время размеры выборки для оснащенных измерительной аппаратурой особей малы в соотношении с популяцией Региона (0,005%), и сосредоточены в основном (> 90% случаев применения) на самках репродуктивного возраста. Таким образом, задача состоит в том, чтобы оснастить аппаратурой достаточное количество особей с целью получения репрезентативного понимания каждой популяции, особенно для более крупных популяций, размножающихся за пределами Региона, но активно кормящихся в его пределах. Без оптимизации размеров выборки также затруднительным представляется точное определение степени пересечения (в плане территории и ресурсов) между местами кормления южных морских слонов и потенциальной рыболовецкой деятельностью, которая может негативно воздействовать на животных в пределах Региона.
Благодаря последним достижениям в сфере технологий и использованию более сложных подходов к моделированию, теперь существуют гораздо более простые решения для некоторых из упомянутых выше задач. Такие исследования способны более полно показать, каким образом деятельность человека может повлиять на южных морских слонов.
Не располагая актуальными данными, будет сложно понять и спрогнозировать, каким образом прошлые, нынешние и ожидаемые изменения климата в сочетании с возрастающим интересом к коммерческому рыболовству повлияют на глобальную популяцию южных морских слонов. Одна из гипотез предполагает, что следует ожидать специфичных для региона влияний. Потенциально некоторые популяции морских слонов могут получить преимущества за счет увеличения доступности наземных местообитаний, в то время как другие могут сократиться, поскольку изменения в доступности и распределении добычи требуют индивидуальных поведенческих изменений, что в конечном итоге приводит к потере численности популяции.
Ожидается, что изменения характеристик морского льда вследствие изменения климата наименее негативно повлияет на распределение и численность устойчивых ко льду морских слонов по сравнению с другими антарктическими тюленями. Действительно, с отступлением льда случаи размножения морских слонов вдоль побережья Антарктики могут стать более частыми по мере появления подходящих для этого мест. Кроме того, южным морским слонам может потребоваться корректировка стратегий кормодобывания, поскольку ожидается, что воздействие на морских млекопитающих будет опосредовано, в первую очередь, за счет изменений в распределении и численности добычи.
Необходимо продолжать и совершенствовать оценку размера популяции, временную оценку состояния тела тюленя и мониторинг иммиграции в Регион и эмиграции из него с помощью исследований методом метки и повторной поимки. Также необходимо продолжить более детальные исследования пищевого поведения и поведения при поиске пищи с использованием ряда недавно разработанных инструментов снабжения животных миниатюрными электронными метками и химических методов, чтобы дополнить целостное понимание воздействия человека на данный вид. Учитывая отсутствие современных и исторических данных, было бы преждевременно на данном этапе делать вывод о том, что южные морские слоны, обитающие и питающиеся в пределах Региона, находятся в безопасности и защищены в обозримом будущем.






