Marthán N. Bester(1), Horst Bornemann(2), Gustavo A. Daneri(3), John van den Hoff(4)
- Mammal Research Institute, Department of Zoology and Entomology, University of Pretoria, South Africa
- Alfred-Wegener-Institut, Helmholtz-Zentrum für Polar- und Meeresforschung, Bremerhaven, Germany
- División Mastozoología, Museo Argentino de Ciencias Naturales “Bernardino Rivadavia” CONICET, Argentina
- Australian Antarctic Division, Tasmania, Australia
- Pese a la matanza indiscriminada de elefantes marinos del sur para la extracción comercial de grasa animal que se produjo durante la segunda mitad del siglo XIX, su población se ha mantenido en casi todos los sitios de reproducción históricos.
- En la actualidad hay aproximadamente 749 000 elefantes marinos del sur en el océano Austral, un 2 % (14 500) de los cuales vive de manera permanente en la zona del Tratado Antártico, al sur de los 60 grados de latitud sur.
- Aunque estas poblaciones reproductoras permanentes del extremo austral son relativamente pequeñas, una gran parte (aún por determinar) de ejemplares originarios de los principales sitios de reproducción subantárticos pasa entre un 70 y 80 % de su tiempo en el mar al sur de los 60º, alimentándose de gran variedad de presas presentes en la plataforma continental antártica y en las cercanías del borde de hielo marino. Ambas regiones están reaccionando al cambio climático.
- Los elefantes marinos del sur se alimentan de gran variedad de especies de peces y calamares de uso comercial, y, dado que sus inmersiones pueden llegar a profundidades de entre 1000 y 2000 metros, están expuestos a la captura secundaria, la que con frecuencia (~90 %) lleva a una interacción letal con la actividad pesquera, principalmente la de la pesca con palangre de austromerluza (especie Dissostichus)
- Es necesario investigar la relación que existe entre los elefantes marinos del sur y la cosecha de kril (Euphausia superba) en la zona del Tratado Antártico.
- Se desconoce y es incierta la forma en que las poblaciones de elefantes marinos responderán, por separado y de manera acumulativa, a los efectos del cambio climático y al posible incremento en la extracción comercial de alimentos en sus áreas de búsqueda de alimento.
Distribución y abundancia
Las poblaciones de elefantes marinos del sur (Mirounga leonina) se han recuperado gracias a medidas de conservación aplicadas luego de haberse visto gravemente mermadas con la extracción comercial de grasa animal durante la segunda mitad de siglo XIX. Su cantidad volvió a reducirse entre 1950 y 1990 por motivos desconocidos, pero se estabilizó posteriormente, llegando a aumentar en algunos lugares. Con una población que asciende a 749 0001 ejemplares, los elefantes marinos se producen en cuatro grupos genéticamente distintos a lo largo del océano Antártico2. Dos de estos grupos se encuentran en el sur del océano Atlántico , otro en el sur del océano Índico y el cuarto en el sur del océano Pacífico. Aunque las principales poblaciones reproductoras se producen en la región septentrional de la zona del Tratado Antártico, hay poblaciones reproductoras más reducidas en islas de la zona de la Península Antártica al interior de la zona abarcada por el Tratado (Figura 1). En la actualidad se estima que una población en torno a los 14 500 ejemplares, es decir, aproximadamente un 2 % de la población total de elefantes marinos del sur, pasa todo el año en la zona del Tratado Antártico.
Como el acceso a la costa Antártica queda restringido en octubre debido al hielo marino, su reproducción en el continente es escasa3,4. Sin embargo, se sabe de pequeñas poblaciones de entre 20 y 500 ejemplares, en su mayoría machos de todas las edades, que visitan las zonas sin hielo del continente antártico (Figura 1) para su muda anual (que se produce entre enero y abril), cuando la cantidad mínima de hielo estival permite el acceso a la costa. La lejanía de algunos lugares de muda puede dificultar el seguimiento de la cantidad de ejemplares, pero se sabe que cuando hay actividad humana en las cercanías se produce una variación anual (datos no publicados de Van den Hoff).
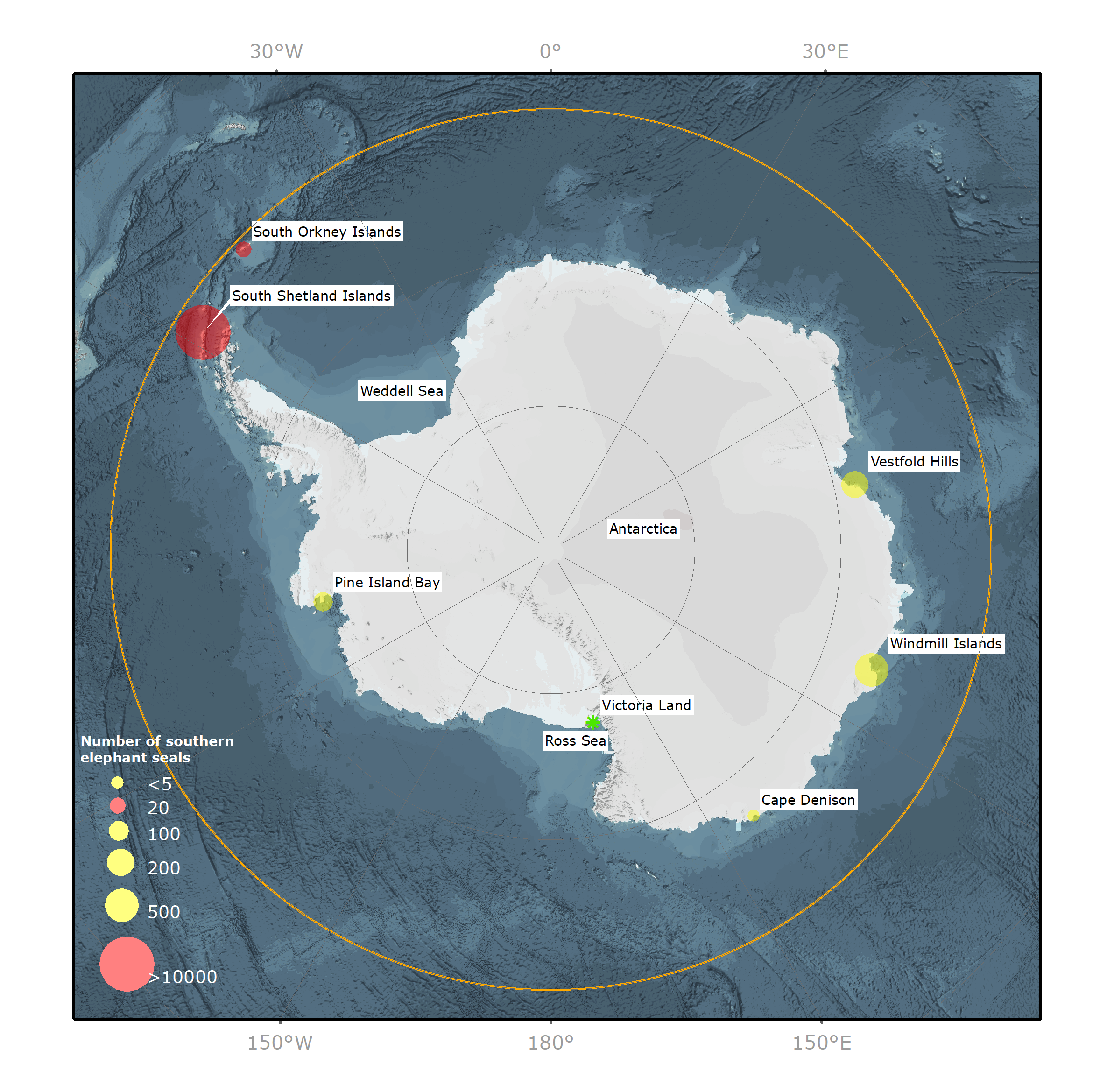
Figura 1. Vista del Polo Sur de la Antártica y del océano Austral en la que se muestran la distribución y abundancia de elefantes marinos del sur (Mirounga leonina) en los lugares de reproducción (punto rojo) y de muda (punto amarillo). Línea naranja = límite norte de la zona del Tratado Antártico a 60º de latitud S. Estrella verde = sitio de reproducción anterior.
Poco se sabe de la regulación natural de las poblaciones de esta especie, especialmente con respecto a las poblaciones ubicadas en la zona del Tratado Antártico. Uno de los factores es la predación por parte de las orcas (Orcinus orca) presentes en la región subantártica, especialmente en las poblaciones reproductoras más reducidas5. Las mordeduras observadas en ejemplares sobrevivientes sugieren que el tiburón dormilón (Somniosus antarcticus) y otras especies de tiburón también atacan a los elefantes marinos del sur, si bien sin éxito en muchas ocasiones6.
En la isla Macquarie hay indicios de que la variabilidad climática puede incidido en la demografía de las hembras reproductoras de esta especie7. El riesgo de que el clima influya en sus poblaciones tiene implicancias para su regulación ante los futuros cambios en el clima mundial. Sin embargo, tras mucha investigación, siguen sin conocerse hasta la fecha las causas de las tendencias de largo plazo observadas en las poblaciones de elefantes marinos del sur, así como su vulnerabilidad al cambio climático. Hay bastante mayor claridad con respecto a otras presiones antropogénicas originadas en la pesca comercial. Existe mortalidad incidental de ejemplares a causa de la pesca exploratoria y comercial con palangre de austromerluza (especie Dissostichus)8,9 (Figura 2). Además, es necesario investigar más profundamente la relación entre las especies de focas, la pesca de austromerluza y la cosecha de kril (E. superba) en la zona del Tratado Antártico.

Figura 2. Ocasionalmente los elefantes marinos del sur (Mirounga leonina) son afectados por la "captura secundaria" debido a la pesca con palangre de austromerluza (Dissostichus spp.). Observadores científicos recopilan datos sobre la mortalidad incidental asociada a la actividad pesquera, la cual es compilada en un informe anual por la CCRVMA (por ejemplo, https://www.ccamlr.org/en/wg-fsa-2019/16-rev-2). Por lo general la mortalidad de elefantes marinos se produce debido al ahogamiento durante el periodo de inmersión de palangres. Este joven ejemplar quedó enganchado por la boca, quedando atrapado en el palangre. Probablemente se ahogó a una profundidad de ~ 950 m. Es difícil determinar cuántos animales mueren cada año a causa de la actividad pesquera en el océano Austral, ya que existen muchas contradicciones entre los diferentes informes sobre pesca y se desconoce la intensidad de las actividades de pesca ilegal. Foto: se ha omitido el nombre debido a motivos comerciales.
Aunque los elefantes marinos del sur normalmente pasan más del 85 % alimentándose en el mar, en la ZAP salen a tierra como adultos dos veces al año, una vez para alimentarse, desde fines de septiembre hasta principios de noviembre (primavera austral) y otra vez para su muda anual, que se produce entre diciembre y marzo (verano austral). Los ejemplares más jóvenes también se acercan a la costa dos veces al año, si bien están ausentes durante la época de reproducción. Los juveniles comienzan su fase de muda en noviembre y pueden tener breves apariciones en tierra a mediados de año, durante un periodo conocido como congregación de mediados de invierno.
El hábitat preferido de los elefantes marinos del sur en fase de muda en las zonas continentales e isleñas sin hielo en la zona del Tratado Antártico10 son las playas de arena de pendiente suave que ofrecen acceso a zonas comunes conocidas como revolcaderos de muda. Esta preferencia en cuanto a hábitat suele tener como resultado la coexistencia con las operaciones humanas y con la infraestructura y actividades asociadas (Figura 3).

Figura 3. Vista al norte desde las colinas Vestfold, Antártida oriental, hacia el borde de hielo marino que avanza. Una vez completa la muda anual en tierra, estos machos de elefantes marinos del sur (Mirounga leonina) deben atravesar el hielo para llegar a las zonas de búsqueda de alimento invernal. Cabe destacar la cercanía entre la infraestructura de la estación (muelle y contenedores) y la playa en la que los elefantes marinos llevan a cabo su muda. Foto: Rachel McInerney.
El ambiente antártico seco y frío combinado con el uso reiterado de algunos sitios de muda permitieron la conservación y acumulación del pelaje suelto. Las investigaciones llevadas a cabo en los revolcaderos que suelen usar en las colinas Vestfold revelaron que el pelaje suelto se ha acumulado durante varios miles de años alcanzando profundidades de 90 cm (datos no publicados de Van de Hoff) (Figura 4).

Figura 4. Vista parcial de un extenso sitio de muda de los elefantes marinos del sur (revolcadero) en las colinas de Vestfold, Antártida Oriental. Cabe destacar los depósitos estratificados pelo y heces, en este caso, de aproximadamente 70 cm de profundidad. Las aguas abiertas desde febrero hasta principios de abril permiten el ingreso de estos animales a la zona. Escala en cm.
Las hembras de elefante marino del sur pueden crecer hasta los 2,8 m y pesar hasta 900 kg. Los machos adultos son considerablemente mayores, llegando a los 5 m de largo y a un peso de 5 toneladas. Las hembras pueden vivir más de 23 años y alcanzan su madurez reproductiva entre los 2 y 6 años. Los machos son capaces de reproducirse entre los 4 y los 5 años y alcanzan la madurez social entre los 6 y los 8 años, si bien la mayoría de los machos reproductores tienen entre 9 y 12 años de edad. Las hembras de entre 3 y 23 años o más dan a luz una sola cría desde fines de septiembre hasta principios de noviembre, y por lo general lo hacen en grupos de dos o más hembras, llamados «harenes»11 (Figura 1). Las crías maman durante unas 3 semanas hasta fines de noviembre, si bien esto suele tardar un poco más a latitudes más elevadas en la zona del Tratado Antártico, cuando la llegada a tierra de las hembras alcanza su apogeo unos 11 días después que en latitudes subantárticas12. Justo antes del destete de las crías, las hembras adultas se aparean en tierra con los machos dominantes (amos de la playa). Los machos menos dominantes (lacayos de los amos de la playa) tienen la oportunidad de aparearse en harenes que por lo general tienen más de 60 hembras. Después de la época de reproducción, todos los adultos participantes entran al mar13.
Las crías de las poblaciones que viven en la zona del Tratado Antártico en la península antártica son más grandes al momento del destete14, y entre todas las poblaciones, estas hembras son las de mayor tamaño15. Según dichos estudios, la alta disponibilidad local de alimentos en la ZAP contribuye al tamaño excesivo de las hembras, lo que, a su vez, beneficia a las crías durante la lactancia.
Tanto la duración como la profundidad de las inmersiones varían en función del sexo, la edad y la región en la que se encuentre esta especie. Las inmersiones de los ejemplares adultos en la ZAP son prolongadas y profundas. Las hembras se sumergen a profundidades medias (± desviación estándar) de 368 (± 83) m. Sin embargo, la profundidad máxima promedio alcanza los 1099 (± 400) m. La mayor profundidad de inmersión registrada para un elefante marino del sur hembra ha sido de 2378 m. Las inmersiones duran en promedio 24,6 (± 5,6) minutos, la duración máxima promedio alcanza los 67 (± 18,2) minutos y la máxima absoluta llega a los 92,3 minutos. Los machos se sumergen a una profundidad promedio de 399 (± 49) m. La máxima profundidad promedio alcanza los 1275 (± 282) m. La mayor profundidad de inmersión registrada para un macho ha sido de 1629 m. Las inmersiones duran en promedio 24,5 (± 3,8) minutos, la duración máxima promedio es de 70,6 (± 9,9) minutos y la máxima absoluta alcanza los 82,3 minutos1. Esta información indica que los elefantes marinos del sur pueden desplazarse hasta 5 km bajo el agua durante aproximadamente una hora y media.
Por lo general, los elefantes marinos de la zona del Tratado Antártico se sumergen a grandes profundidades y se alimentan principalmente en las zonas de profundidad media (mesopelágicas) de la columna de agua. Las prolongadas inmersiones se ven interrumpidas por breves intervalos en la superficie de aproximadamente 2 a 3 minutos. Muestran patrones de inmersión vertical diurna, sumergiéndose a profundidades menores por la noche y en el ocaso y a mayor profundidad durante el día. Es probable que estos patrones respondan a la migración vertical de las presas11.
La ecología trófica de los elefantes marinos del sur tiende a vincularse con una serie de propiedades físicas oceanográficas, en particular con la concentración de la capa de hielo marino y la temperatura del agua. A profundidades de forrajeo, la temperatura del agua, los niveles de luz superficial y el porcentaje de luz superficial que alcanza los 150 m influyen también en la búsqueda de alimentos diurna, nocturna, crepuscular, al término de la primavera y al principio del verano16. Sin embargo, en la naturaleza de estas relaciones existen diferencias en función de las distintas poblaciones, estaciones del año, latitudes y sexo1,16.
Establecer el rango total de las especies que son presa de los elefantes marinos del sur durante sus largas migraciones oceánicas presenta muchos retos. Los elefantes marinos del sur se alimentan principalmente de especies ícticas y calamares que habitan en las profundidades, si bien es escasa la información con que se cuenta sobre los lugares donde lo hacen. El lavado estomacal de hembras adultas presentes en la zona del Tratado Antártico puso de manifiesto que su principal presa son los cefalópodos, especialmente el calamar glacial antártico Psychroteuthis glacialis y otras especies musculares tales como el Alluroteuthis antarcticus y el Moroteuthis knipovitchi, seguidas de peces. Entre estos, se encontró principalmente peces linterna, como Gymnoscopelus nicholsi y Electrona antarctica, así como el diablillo antártico (Pleuragramma antarctica) a latitudes más altas. Los ejemplares macho comparten, especialmente, el grupo de especies de calamar que consumen las hembras, si bien se alimentan más del pulpo béntico Pareledone17,18. Además de cefalópodos y peces, es posible que el crustáceo eufáusido, muy probablemente la especie Euphausia (kril), constituya una importante presa estacional para los ejemplares juveniles19,20.
La dieta de los elefantes marinos del sur se deduce del análisis de ácidos grasos e isótopos estables de nitrógeno y carbono que se acumulan en zonas del cuerpo como producto de su ingesta. Por lo general, estos estudios confirman los estudios de lavado, lo que demuestra que esta especie es un depredador de una combinación de peces y calamares y que los ejemplares juveniles pueden ser depredadores de eufásidos20. Además, otros estudios de este tipo también han demostrado que las proporciones de estos grandes grupos de presas (peces, calamares, combinación de ambos) pueden variar según el tiempo y el espacio20,21.
En cuanto a tiempo, el comportamiento migratorio de los elefantes marinos del sur es predecible: existe un periodo pelágico posterior a la reproducción que dura unos 2 a 3 meses entre las hembras adultas (aproximadamente desde fines de octubre hasta enero) y de unos 4 a 6 meses entre los machos adultos, después de lo cual regresan a tierra para su muda anual. Al periodo de la muda en tierra le sigue otro periodo en el mar hasta que regresan a tierra para su reproducción. En cuanto a espacio, las distancias de viaje promedio (+ desviación estándar) que viajan las hembras y los machos adultos de elefantes marinos del sur en la zona del Tratado Antártico para su muda y reproducción alrededor de la Península Antártica son de 1464 ± 767 km (máx. 3547 km) y 1270 ± 1105 km (máx. 3133 km), respectivamente1. Muchos permanecen en la plataforma occidental de la península Antártica o cerca de esta, si bien algunos llevan a cabo largas migraciones hacia el oeste a lo largo del borde de hielo, coincidiendo con la población de focas de la isla Macquarie22. Las cifras varían entre las distintas poblaciones y con la batimetría de sus zonas de búsqueda de alimento, así como en función de si los animales usan una estrategia de inmersión pelágica o bentónica23,24. En la ZAP, los elefantes marinos aprovechan estacionalmente la zona de los márgenes de hielo marino y las áreas de mayor productividad que se asocia al borde de hielo, pero es posible que, además, se aventuren en el banco de hielo compacto, incluidas las zonas con alta concentración de hielo a lo largo del talud continental del Mar de Weddell interior25,26,27.
Aunque se lleva a cabo un seguimiento frecuente de los elefantes marinos del sur que frecuentan las zonas cubiertas de hielo desde las colonias de reproducción de las latitudes altas, como las que están asociadas a la ZAP, este seguimiento se lleva a cabo también desde las islas ubicadas al norte de la zona del Tratado Antártico1. Las focas que vienen del sur del océano Índico y del sur del océano Pacífico por lo genera transitan rápidamente hacia el sur hacia aguas antárticas siguiendo movimientos serpenteantes, ya sea en las aguas relativamente confinadas estacionalmente a lo largo de la plataforma de hielo estacional a lo largo de la costa de la Antártida Oriental, en parte en relación con las polinias, o dentro de los bancos de hielo en el sector norte del Mar de Ross.
Actualmente (2020), los elefantes marinos del sur se encuentran incluidos en la Lista Roja de la Unión Internacional para la Conservación de la Naturaleza (UICN) con la categoría de «especie menos afectada». También se incluyen en el Apéndice II de la Convención sobre el Comercio Internacional de Especies Amenazadas de Fauna y Flora Silvestres (CITES). En la zona del Tratado Antártico, los elefantes marinos del sur están expresamente protegidos en virtud de la Convención para la Conservación de las Focas Antárticas (CCFA). El Protocolo al Tratado Antártico sobre Protección del Medio Ambiente (Protocolo de Madrid) aplica medidas de protección general de la fauna y flora autóctonas. La Convención para la Conservación de los Recursos Vivos Marinos Antárticos (CCRVMA) considera a todas las especies de focas como componentes del ecosistema del océano Austral, lo que incluye consideraciones relativas al impacto de las operaciones pesqueras sobre las áreas de búsqueda de alimentos y las presas de las focas. La CCRVMA aplica firmes medidas para reducir la captura incidental de focas y aves, pero dichas medidas no impiden cierto nivel de mortalidad de las especies afectadas tanto al interior como al exterior de la zona del Tratado Antártico9 (Figura 3).
El estado actual de los conocimientos pone de manifiesto que los elefantes marinos del sur se ven directamente afectados por el ser humano debido a la perturbación y la mortalidad incidental, e indirectamente debido a los cambios en el ecosistema marino que pueden estar relacionados con las tendencias del clima mundial. No existe claridad con respecto a los motivos de los cambios actuales y pasados en la cantidad de ejemplares. Sin embargo, es probable que esto sea producto de los cambios relacionados con el clima en el hábitat y el ecosistema2, los que se asocian con el ecosistema marino y principalmente con los cambios en la distribución y abundancia de las presas28. Cabe destacar que los cambios observados en la cantidad de elefantes marinos del sur son coherentes con los cambios en la abundancia observados o previstos en la cantidad de otros importantes depredadores presentes en la ZAP como respuesta al cambio climático29. Sin embargo, existe una gran incertidumbre con respecto a la forma en que responderán los elefantes marinos del sur a las presiones antropogénicas y naturales en todo el océano Austral30, que puede continuar sufriendo importantes cambios asociados al calentamiento de las masas de agua, la intensificación de los vientos provenientes del poniente, el cambio de los sistemas frontales oceánicos hacia los polos, además del retiro del hielo marino y de la plataforma de hielo en algunas regiones31.
Uno de los desafíos para la investigación será la recopilación de información que lleve a una comprensión integral de los hábitos de búsqueda de alimentos de los elefantes marinos del sur al interior de la zona del Tratado Antártico. Gracias a sistemas de cámaras colocadas en los animales, ahora se puede observar su consumo de presas de manera directa y durante periodos prolongados (de más de 10 años). Dicha información contribuirá a un mejor conocimiento de las especies que son presa, las especies que coinciden con la actividad pesquera, los cambios en el tiempo en la frecuencia con la que aparecen las presas y los cambios asociados a las estrategias de alimentación que pueden permitir que estas especies se adapten a los cambios en los recursos alimenticios en la zona del Tratado Antártico. Tales estudios permitirán profundizar los conocimientos relativos a la alta especialización trófica observada entre los ejemplares de elefantes marinos del sur que podrían limitar dicha adaptación32.
Se recopilaron datos demográficos y morfométricos de una gran variedad de poblaciones de elefantes marinos del sur, incluida la zona del Tratado Antártico. Sería provechoso reanudar estudios similares orientados a la recopilación de datos comparativos para evaluar de qué manera los cambios asociados al clima en el hábitat pueden haber afectado a estas poblaciones. Por ejemplo, en 1997 la cantidad de crías luego del destete fue mucho mayor en la ZAP que en otras ubicaciones, lo que es posible que se deba a la cantidad local de alimento disponible33. ¿Sigue ocurriendo lo mismo? En este punto el desafío será coordinar tal estudio en una serie de poblaciones y durante varios años.
Se espera que dentro del zona del Tratado Antártico los cambios regionales en el clima beneficien a los elefantes marinos del sur debido a la aparición de más playas sin hielo adecuadas para su actividad en tierra tales como la muda y la reproducción34. De hecho, las conclusiones basadas en datos genéticos sugieren que se encontró una población reproductora, ahora extinta, en el Mar de Ross, en la costa de la Tierra Victoria (Figura 1), cuya abundancia aumentó de manera considerable con el deshielo hace unos 8000 años para luego disminuir hasta su extinción con el retorno del hielo hace aproximadamente 1000 años35. Actualmente el tamaño de las poblaciones ha aumentado36,37 en la ZAP, pero debido a que la extensión del hielo marino bloquea el acceso a las playas durante el periodo de reproducción en octubre, los lugares de reproducción en la Antártida continental se mantienen en el mínimo. Por otro lado, es poco lo que se sabe de los cambios en la población no reproductora (en fase de muda) y sobre si los cambios pueden relacionarse con alteraciones en las principales poblaciones subantárticas de elefantes marinos del sur, las cuales son las poblaciones de origen para la zona del Tratado Antártico. Para responder a estas preguntas es necesario llevar a cabo un mayor seguimiento y supervisión de las poblaciones en los posibles hábitats de la zona del Tratado Antártico, así como en poblaciones de referencia subantárticas.
Además, sería muy provechoso integrar los datos biológicos con los datos oceanográficos físicos simultáneos in situ con el fin de analizar el comportamiento de los elefantes marinos del sur y sus efectos en las dinámicas poblacionales1. Debería alentarse este uso, ya que permitiría cuantificar la manera en que los cambios en el entorno, anuales y a lo largo de varios años, afectan el comportamiento de los animales, y la probabilidad de que esto se traduzca en los índices de crecimiento demográfico1. Actualmente el tamaño de muestras de ejemplares con dispositivos de seguimiento es relativamente pequeño en comparación con el tamaño de la población presente en la zona del Tratado Antártico (0,005 %), y las muestras se centran principalmente en las hembras en etapa reproductiva (> 90 % de las implantaciones). Por lo tanto, el desafío es poner dispositivos en suficientes ejemplares con el fin de obtener información representativa de cada población, especialmente en las poblaciones de mayor tamaño que se reproducen fuera de la zona del Tratado Antártico pero que buscan alimento en su interior. Si no se mejora el tamaño de las muestras, se dificultará también el cuantificar a ciencia cierta el grado de superposición (en términos de espacio y de recursos) entre las zonas de búsqueda de alimentos de los elefantes marinos del sur y las futuras actividades pesqueras que puedan tener un impacto adverso en esta especie al interior de la zona del Tratado Antártico.
Algunos de los desafíos mencionados pueden abordarse ahora con mayor facilidad gracias a los recientes avances tecnológicos y el uso de metodologías de modelamiento más sofisticadas. Tales estudios tienen el potencial de revelar en forma más integral la respuesta en el tiempo de los elefantes marinos del sur ante la actividad humana.
Sin datos recientes, será difícil comprender y pronosticar la forma en que población mundial de elefantes marinos del sur resultará afectada por los cambios pasados, presentes y futuros en combinación con el efecto del mayor interés en la pesca comercial. Una hipótesis es que pueden esperarse influencias específicas de la región. Es posible que algunas poblaciones de la zona del Tratado Antártico se beneficien de la mayor disponibilidad de hábitats terrestres, en tanto que otras pueden reducirse debido a que los cambios en la disponibilidad y distribución de los recursos suponen cambios en el comportamiento de los ejemplares, lo que, en definitiva, deriva en la disminución de la población.
Entre las focas antárticas, se espera que la distribución y abundancia de los ejemplares de elefantes marinos del sur, tolerantes al hielo, sean los menos afectados por los cambios en las características del hielo debido al cambio climático. En efecto, con el retroceso del hielo, la cantidad de elefantes marinos que se reproducen a lo largo de la costa antártica podría aumentar a medida que se produzcan más hábitats disponibles para la reproducción. Por otro lado, es posible que los elefantes marinos del sur deban adecuar sus estrategias de alimentación, ya que se espera que los cambios en la distribución y abundancia de los recursos influyan en estos mamíferos marinos.
Se necesitan evaluaciones constantes y mejoradas del tamaño de las poblaciones, además de evaluaciones temporales del estado físico de estos animales y el control de los movimientos migratorios desde y hacia la zona del Tratado Antártico mediante estudios de marcaje y recaptura. Además, deben seguir perfeccionándose los estudios sobre el comportamiento alimentario y de búsqueda de alimentos mediante el uso de una serie de tecnologías de seguimiento, o biologging, y técnicas químicas desarrolladas recientemente para complementar el conocimiento integral del impacto del ser humano en estos animales. Teniendo en cuenta la falta de datos actuales que puedan compararse con datos históricos, sería prematuro en esta fase concluir que los elefantes marinos del sur que viven y se alimentan en la zona del Tratado Antártico estarán a salvo y seguros en un futuro previsible.






