Marthán N. Bester(1), Horst Bornemann(2), Gustavo A. Daneri(3), John van den Hoff(4)
- Mammal Research Institute, Department of Zoology and Entomology, University of Pretoria, South Africa
- Alfred-Wegener-Institut, Helmholtz-Zentrum für Polar- und Meeresforschung, Bremerhaven, Germany
- División Mastozoología, Museo Argentino de Ciencias Naturales “Bernardino Rivadavia” CONICET, Argentina
- Australian Antarctic Division, Tasmania, Australia
- En dépit de l’abattage massif des éléphants de mer austraux, réalisé pour la production commerciale d’huile de graisse au milieu et à la fin du XIXesiècle, les populations de cette espèce ont perduré dans la plupart des sites de reproduction historiques.
- On estime la présence actuelle de 749 000 éléphants de mer austraux dans l’océan Austral, dont environ 2 % (14 500) vivent en permanence dans la zone du Traité sur l’Antarctique au sud du 60eparallèle Sud.
- Bien que ces populations permanentes reproductrices situées le plus au sud soient relativement minimes, une grande proportion (encore à déterminer) de spécimens originaires des principaux sites de reproduction subantarctiques passent 70 à 80 % de leur temps en mer au sud du 60eparallèle Sud à se nourrir d’une multitude de proies sur le plateau continental antarctique et près de la limite des banquises, ces deux zones réagissant au changement climatique.
- Les éléphants de mer austraux se nourrissent d’une multitude de poissons et de calmars susceptibles d’être ou déjà commercialisés. Comme leurs plongées peuvent atteindre des profondeurs de 1 000 à 2 000 m, ils sont exposés à des risques d’interactions potentielles fortuites et souvent (à env. 90 %) mortelles avec les activités de pêche commerciale, notamment avec la pêche à la palangre de la légine (Dissostichus).
- La relation entre les éléphants de mer austraux et la pêche au krill (Euphausia superba) dans la zone du Traité sur l’Antarctique doit encore être étudiée.
- La réaction des populations d’éléphants de mer tant individuelle que conjointe aux effets du changement climatique et à l’augmentation potentielle des prélèvements de nourriture à des fins commerciales dans leurs sites nourriciers reste largement inconnue et incertaine.
Distribution et abondance
Les populations d’éléphants de mer austraux (EMA) Mirounga leonina, lourdement décimées, se sont reconstituées sous protection après avoir été largement exploitées au milieu et à la fin des années 1800 en vue de la production commerciale d’huile de graisse. Leur nombre a chuté à nouveau pour des raisons inconnues entre les années 1950 et 1990, puis s’est stabilisé, et, à certains endroits, a même augmenté. La population d’EMA dénombre 749 0001 individus et est répartie entre au moins quatre groupes génétiquement distincts dans l’ensemble de l’océan Austral2. Deux d’entre eux se situent dans l’océan Atlantique Sud (OAS), un dans l’océan Indien Sud (OIS) et un quatrième dans l’océan Pacifique Sud (OPS). Bien que les principales populations reproductrices vivent au nord de la Zone du Traité sur l’Antarctique (ZTA), d’autres populations reproductrices plus réduites se concentrent majoritairement sur des îles de la Zone de la Péninsule Antarctique (ZPA) dans la ZTA (Figure 1). Actuellement, on estime la présence de 14 500 individus, soit env. 2 % de la population totale des EMA, dans la ZTA tout au long de l’année.
L’accès aux côtes de l’Antarctique étant limité en octobre par les glaces de mer, les mises bas sur le continent se font rares3,4. Cependant, des populations plus réduites de 20 à 500 individus, principalement des EMA mâles de tous les âges, se déplacent dans les zones exemptes de glace du continent antarctique (Figure 1) pour leur mue annuelle (de janvier à avril) lorsque l’étendue minimale des glaces de mer estivales permet l’accès aux côtes. Du fait de l’éloignement de certains sites de mue, leur nombre peut s’avérer difficile à surveiller, mais lorsque les humains évoluent à proximité de ces emplacements, on sait que leur nombre varie chaque année (données non publiées de J. van den Hoff).
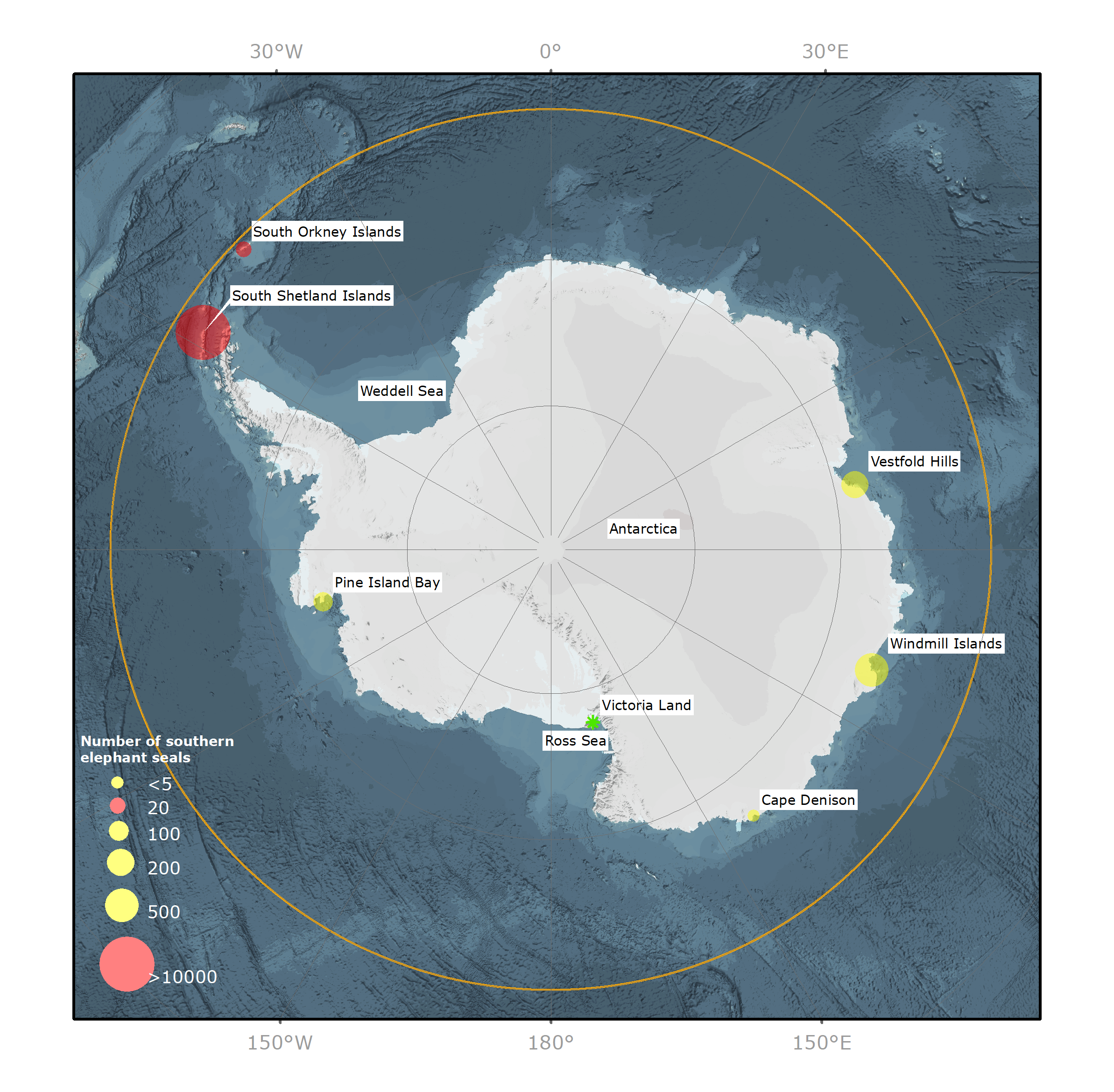
Figure 1. Vue du pôle sud de l’Antarctique et de l’océan Austral illustrant la distribution et l’abondance de l’éléphant de mer austral (Mirounga leonina) sur les sites de reproduction (point rouge) et de mue (point jaune). Ligne orange = limite nord de la zone du Traité sur l’Antarctique à la latitude 60º S. Étoile verte = site de reproduction historique.
La régulation naturelle des populations de cette espèce est peu connue, notamment pour les populations situées sur la ZTA. Le phénomène de prédation par les orques (Orcinus orca) dans la région subantarctique joue un rôle prépondérant, en particulier pour les petites populations reproductrices5. Les blessures par morsure, observées sur des sujets survivants, laissent penser que les requins dormeurs (Somniosus antarcticus), et d’autres espèces de requins attaquent également les EMA, mais toutes les tentatives de prédation ne sont pas couronnées de succès6.
Par ailleurs, il a été prouvé que la variabilité du climat peut avoir des conséquences démographiques sur la reproduction des EMA femelles sur l’île Macquarie7. Le fait que le climat puisse influencer les populations d’EMA entraîne des répercussions sur leur mode de régulation face aux futurs changements climatiques de la planète. Et pourtant, au terme de nombreuses recherches, les facteurs responsables des tendances à long terme observées jusqu’à présent pour les populations d’EMA restent inconnus, tout comme leur sensibilité au changement climatique. D’autres facteurs de pression d’origine humaine sur les populations d’EMA apparaissent beaucoup plus clairement, comme la pêche commerciale. On observe une mortalité accidentelle d’individus en lien avec les pêches commerciales et exploratoires à la palangre de la légine (Dissostichus spp.) établies8,9 (Figure 2), et la relation entre l’éléphant de mer, la légine et la pêche au krill (E. superba) dans la ZTA doit être explorée de façon plus approfondie.

Figure 2. Les éléphants de mer austraux (Mirounga leonina) sont parfois des « prises accidentelles » de la pêche à la palangre de la légine (Dissostichus spp.). Des données sur cette mortalité accidentelle liée aux activités de pêche sont collectées par des observateurs scientifiques et communiquées chaque année par la Convention CCAMLR (p. ex. : https://www.ccamlr.org/en/wg-fsa-2019/16-rev-2). Les mortalités sont généralement dues à des noyades pendant la période d’immersion de la palangre. Ce jeune phoque a été hameçonné au niveau de la bouche, puis il s’est enchevêtré dans la ligne de palangre et s’est probablement noyé à une profondeur d’environ 950 m. Les incohérences relevées dans les rapports des différentes pêcheries et le nombre inconnu des activités de pêche illégale compliquent le calcul du nombre d’éléphants de mer austraux tués chaque année lors de campagnes de pêche dans l’océan Austral. Photo : nom retenu pour des raisons commerciales.
Bien que l’EMA consacre en règle générale plus de 85 % de sa vie à la recherche de nourriture en mer, à l’âge adulte, il s’échoue deux fois par an sur la terre ferme de la ZPA : une fois pour se reproduire de fin septembre à début novembre (printemps austral) et une autre fois pour accomplir sa mue annuelle de décembre à mars (été austral). Les plus jeunes, absents pendant la saison de reproduction, s’échouent également deux fois par an. La mue des juvéniles commence dès le mois de novembre et ces derniers peuvent apparaître brièvement sur la terre ferme au milieu de l’année pour une période appelée mue de mi-hiver.
Les plages sablonneuses en pente douce semblent être l’habitat de prédilection pour la mue des EMA dans les zones exemptes de glace, que ce soit sur le continent ou sur les îles de la ZTA10 (Figure 2), ces plages donnent accès à des zones communes de rassemblement. Cette préférence d’habitat aboutit souvent à la cohabitation avec les activités humaines, leurs infrastructures et leurs activités connexes (Figure 3).

Figure 3. Vue vers le nord depuis les collines de Vestfold, dans l’Antarctique oriental, en direction de l’avancée des glaces de mer hivernales. Après avoir accompli leur mue annuelle sur terre, ces éléphants de mer mâles (Mirounga leonina) doivent traverser la glace pour atteindre leurs zones hivernales d’alimentation. Notez la proximité des infrastructures de la station (quai et conteneurs) par rapport à la plage où les phoques ont mué. Photo : Rachel McInerney.
L’environnement froid et sec de l’Antarctique, conjugué à l’utilisation répétée de certains sites de mue, a favorisé la conservation et l’accumulation des poils de mue. Des recherches sur les sites de mue utilisés de façon répétée dans les collines Vestfold ont révélé (données non publiées de J. van den Hoff) que les poils tombés se sont accumulés sur une épaisseur de 90 cm pendant plusieurs milliers d’années (Figure 4).

Figure 4. Partie d’un vaste site de mue des éléphants de mer austraux dans les collines de Vestfold, en Antarctique oriental. Notez le dépôt successif de poils et d’excréments, qui atteint ici environ 70 cm d’épaisseur. Les eaux libres de février à début avril permettent aux éléphants de mer d’accéder à cette zone. Échelle en cm.
Les EMA femelles atteignent une longueur d’environ 2,80 m et pèsent jusqu’à 900 kg. Les adultes mâles, quant à eux, dépassent largement ces statistiques puisque leur longueur peut atteindre 5 m et leur poids avoisiner les 5 000 kg. Les femelles bénéficient d’une espérance de vie de 23 ans et plus, et atteignent leur maturité sexuelle entre 2 et 6 ans. Les mâles peuvent se reproduire à partir de 4 ou 5 ans, ils atteignent la maturité sociale entre 6 et 8 ans, mais la majorité des reproducteurs sont âgés de 9 à 12 ans. Les femelles de 3 à 23 ans et plus donnent naissance à un seul petit entre fin septembre et début novembre. Elles sont fréquemment réunies au sein d’un même groupe de deux ou plusieurs femelles, appelé « harem » 11 (Figure 1). Le nouveau-né tète pendant environ 3 semaines, jusqu’à fin novembre ; cette période est souvent légèrement retardée aux latitudes plus élevées de la ZTA, où le pic d’arrivée des femelles se produit environ 11 jours plus tard que sous la latitude subantarctique12. Juste avant le sevrage des petits, les femelles adultes s’accouplent sur la terre ferme avec les mâles dominants (appelés pachas). Les mâles un peu moins dominants parviennent à s’accoupler au sein de harems constitués de plus de 60 femelles. Après la saison de reproduction, tous les adultes repartent en mer13.
Les populations de la ZTA dans la ZPA présentent des petits plus lourds au moment du sevrage14 et les femelles atteignent une corpulence plus importante par rapport aux autres populations15. Il ressort de ces études qu’une disponibilité alimentaire élevée au niveau local dans la ZPA a contribué à la corpulence excessive des femelles, ce qui a profité à leurs petits pendant la période d’allaitement.
Selon le sexe, l’âge et la région, la durée et la profondeur des plongées des EMA varient. Les EMA adultes de la ZPA effectuent des plongées à la fois longues et en profondeur. Les femelles plongent à une profondeur moyenne de 368 m (± 83 m) (± signifiant écart type), cependant la profondeur moyenne maximale est de 1 099 m (± 400 m). La profondeur maximale enregistrée à ce jour pour un EMA femelle est de 2 378 m. La durée moyenne des plongées atteint 24,6 minutes (± 5,6 min), alors que la durée maximale moyenne est de 67,0 minutes (± 18,2 min), avec un record atteignant les 92,3 minutes. Les mâles adultes plongent à une profondeur moyenne de 399 m (± 49 m), cependant la profondeur moyenne maximale est de 1 275 m (± 282 m). La plongée la plus profonde enregistrée à ce jour pour un EMA mâle est de 1 629 m. La durée moyenne des plongées atteint 24,5 minutes (± 3,8 min), alors que la durée maximale moyenne est de 70,6 minutes (± 9,9 min), avec un record atteignant les 82,3 minutes1. Les informations recueillies indiquent que les EMA peuvent se déplacer sous l’eau sur une distance allant jusqu’à 5 km en 1 h 30 environ.
En règle générale, les éléphants de mer au sein de la ZTA plongent très profondément et se nourrissent principalement dans la zone intermédiaire (mésopélagique) de la colonne d’eau. Les longues plongées sont ponctuées de courts intervalles en surface d’environ 2 à 3 minutes. Les EMA poursuivent un rythme de plongée nycthéméral, plongeant à des profondeurs plus faibles la nuit ou au crépuscule, et à des profondeurs plus importantes le jour. Ces rythmes de plongée découlent probablement de la migration verticale des proies11.
L’écologie alimentaire des EMA semble être en corrélation avec un certain nombre de propriétés océanographiques physiques, notamment la concentration de la couverture des glaces de mer et la température de l’eau. Dans les profondeurs réservées à la recherche de nourriture, la température de l’eau, les degrés de luminosité et le pourcentage de la lumière de surface atteignant 150 m influencent également la recherche de nourriture des EMA pendant les périodes de jour, de nuit et de crépuscule, à la fin du printemps et au début de l’été16. Cependant on observe des différences entre les populations, les saisons, les latitudes et les sexes dans la nature de ces relations 1, 16.
La détermination de l’ensemble des espèces proies consommées par les EMA au cours de leurs vastes migrations océaniques présente de nombreux défis. Les EMA se nourrissent essentiellement de poissons et de calmars vivants en profondeur, mais l’on dispose de très peu d’informations sur les endroits où ils les consomment. L’étude de la contenance de l’estomac d’un EMA adulte femelle au sein de la ZTA indique que les céphalopodes, et particulièrement le calmar des glaces Psychroteuthis glacialis et d’autres espèces musculaires telles que le Alluroteuthis antarcticus et le Moroteuthis knipovitchi, représentent les principales proies, suivies par les poissons. Ces derniers sont en grande partie représentés par les poissons-lanternes mésopélagiques tels que le Gymnoscopelus nicholsi et l’Electrona antarctica, ainsi que par la calandre antarctique Pleuragramma antarctica dans les latitudes plus élevées. Les EMA mâles se nourrissent principalement de calmars que consomment aussi les femelles, mais ils absorbent davantage de poulpes benthiques Pareledone17, 18. En plus des céphalopodes et des poissons, les crustacés de l’ordre des Euphausiacés, et plus probablement l’Euphausia spp. (le krill), constituent d’importantes proies saisonnières, notamment pour les juvéniles19, 20.
Le régime alimentaire des EMA a été déterminé à partir d’analyses des acides gras et des isotopes stables de l’azote et du carbone qui se sont accumulés dans diverses parties du corps après l’ingestion. En règle générale, ces études corroborent celles du lavage d’estomac, et indiquent que les EMA sont des prédateurs mixtes poissons-calmars et que certains juvéniles peuvent se nourrir d’euphausiacés20. D’autre part, des études du même type ont également démontré que les proportions de ces immenses groupes de proies (poissons/calmars/mixte) peuvent varier temporellement et spatialement20, 21.
Temporellement, les EMA se déplacent de façon prévisible : après la reproduction, une période pélagique d’environ 2 à 3 mois est observée chez les femelles adultes (vers la fin octobre jusqu’à janvier) et d’environ 4 à 6 mois chez les mâles adultes, après quoi ils retournent sur la terre ferme pour la mue annuelle. Après cette période de mue en milieu terrestre, une autre période s’ensuit en mer jusqu’à leur retour sur la terre ferme pour se reproduire. Spatialement, les distances moyennes de déplacement des EMA pour leur reproduction/mue dans la ZTA autour de la péninsule antarctique équivalent à 1 464 km + 767 km (+ signifiant écart type) (distance maximale observée : 3 547 km) et 1 270 km + 1 105 km (distance maximale observée : 3 133 km) pour les femelles adultes et les mâles adultes respectivement1. La plupart des spécimens restent à proximité ou sur le plateau de la péninsule antarctique occidentale, bien que certains d’entre eux poursuivent une longue migration à la lisière des glaces de mer, rejoignant ainsi les phoques de l’île Macquarie22. Ces effectifs varient selon les groupes de population et selon la bathymétrie de leurs zones d’alimentation, mais également selon la stratégie de plongée adoptée par les animaux, en milieu pélagique ou benthique 23,24. Dans le périmètre de la ZPA, les éléphants de mer exploitent de façon saisonnière la zone marginale des glaces de mer et les secteurs de plus grande productivité situés à la lisière des glaces de mer, mais ils peuvent également s’aventurer sur la banquise, et notamment dans les zones de forte concentration de glaces sur la pente du plateau continental de la partie intérieure de la mer de Weddell25,26,27.
Les EMA qui occupent fréquemment des zones couvertes de glace sont généralement tracés à partir de colonies de reproduction de hautes latitudes comme celles rattachées à la ZPA, mais aussi à partir d’îles situées au nord de la ZTA1. En règle générale, les éléphants de mer de l’OIS et de l’OPS progressent rapidement vers le sud dans les eaux de l’Antarctique, puis ils se déplacent en mouvements sinueux, soit dans les eaux relativement confinées du plateau continental couvertes de glace saisonnière le long de la côte de l’Antarctique oriental, et en partie sous forme de polynies, soit dans la partie nord de la banquise de la mer de Ross.
Les éléphants de mer austraux sont actuellement (en 2020) inscrits sous le statut de « Préoccupation mineure » sur la liste rouge de l’Union internationale pour la conservation de la nature (UICN). Les EMA sont également répertoriés sur l’Annexe II de la Convention sur le commerce international des espèces de faune et de flore sauvages menacées d’extinction (CITES). Dans la zone du Traité sur l’Antarctique, les EMA sont protégés de façon explicite par la Convention pour la protection des phoques de l’Antarctique (CPPA). Le Protocole au Traité sur l’Antarctique relatif à la protection de l’environnement (Protocole de Madrid) applique des mesures de protection génériques à la faune et à la flore indigènes. La Convention sur la conservation de la faune et la flore marines de l’Antarctique (CCAMLR) considère tous les phoques comme des éléments de l’écosystème de l’océan Austral, incluant notamment les répercussions des activités de pêche sur les zones d’alimentation et sur les proies des phoques. La Convention CCAMLR applique des mesures strictes pour atténuer les prises accessoires accidentelles de phoques et d’oiseaux, mais ces dispositions n’excluent pas que les espèces concernées connaissent un certain taux de mortalité, tant à l’intérieur qu’à l’extérieur de la ZTA9 (Figure 3).
Selon les connaissances acquises à ce jour, les EMA sont directement impactés par la présence humaine sous forme de perturbations et de mortalité accidentelle, et indirectement par les modifications des écosystèmes marins qui peuvent être liées aux évolutions du climat sur la planète. Les facteurs décisifs des modifications observées dans le passé et de nos jours sur le nombre des EMA restent obscurs. Cependant, ce phénomène peut résulter de la transformation des habitats et des écosystèmes en relation avec le climat2, en lien avec l’écosystème marin et principalement induit par des variations dans la distribution et l’abondance des proies28. Il convient de souligner que les modifications observées dans les effectifs des EMA correspondent aux changements observés ou prévus en matière d’abondance de divers prédateurs supérieurs présents dans la ZPA en réponse aux changements climatiques29. Toutefois, une grande incertitude subsiste quant à la manière dont les EMA réagiront concrètement face aux pressions d’origine naturelle et anthropique dans l’océan Austral30. Ils pourraient continuer à subir des changements importants liés au réchauffement des masses d’eau, au renforcement des vents d’ouest, au déplacement vers les pôles des systèmes de fronts océaniques, ainsi qu’au recul des glaces de mer et de la glace du plateau continental dans certaines régions31.
Parmi les défis à relever en matière de recherche figure l’acquisition d’une compréhension globale de la quête de nourriture des EMA dans la ZTA. Grâce aux systèmes de caméras fixées sur les animaux, on peut désormais effectuer des observations plus précises à long terme (10 ans ou plus) sur les proies consommées. De telles informations contribueront à une connaissance précieuse des espèces proies consommées, du recoupement des espèces avec les activités de pêche, des changements dans la fréquence des espèces proies au fil du temps et des évolutions liées aux stratégies d’alimentation qui peuvent permettre à cette espèce de s’adapter aux changements des ressources proies dans toute la ZTA. Ce type d’études permettrait également de mieux comprendre la forte spécialisation trophique observée au sein de chaque EMA, qui pourrait potentiellement limiter cette adaptation32.
Pour l’EMA, des données démographiques et morphométriques ont été recueillies auprès d’un large éventail de populations, y compris dans la ZTA. Il serait utile de reprendre des études analogues en vue de collecter des données comparables pour vérifier comment ces populations ont pu être affectées par les changements d’habitat liés au climat. Par exemple, les masses réunies en vue du sevrage des petits EMA dans la ZPA étaient nettement plus importantes par rapport à d’autres sites en 1997, peut-être en raison de l’abondance de la nourriture disponible localement33. Cette situation est-elle toujours d’actualité ? Le défi consistera ici à coordonner une étude similaire sur plusieurs populations et plusieurs années.
Dans le périmètre de la ZTA, les changements climatiques régionaux devraient largement profiter aux EMA, notamment grâce à la création de nouvelles plages exemptes de glace adaptées aux activités terrestres telles que la mue et la reproduction34. En fait, des inférences établies suite à l’étude de données génétiques suggèrent qu’une population reproductrice aujourd’hui éteinte s’était établie dans la mer de Ross, sur la côte de la terre Victoria (Figure 1). Sa population s’est élargie considérablement grâce au recul des glaces environ 8 000 avant le présent (AP), puis a décliné jusqu’à son extinction avec le retour des glaces environ 1 000 ans AP35. Actuellement, dans la ZPA, la population semble croître36,37, mais en raison de l’étendue des glaces de mer qui bloquent l’accès aux plages pendant la période de reproduction en octobre, les sites de reproduction dans l’Antarctique continental restent infimes. De plus, les changements dans la population non reproductrice (en mue) sont peu connus et on ignore s’ils pourraient être liés à des altérations dans les principales populations d’EMA subantarctiques, qui servent de populations sources pour la ZTA. Améliorer la surveillance et le suivi des habitats potentiels au sein de la ZTA, et des populations sources subantarctiques est nécessaire pour répondre à de telles questions.
Intégrer les données biologiques avec les données océanographiques physiques in situ représente également des avantages indéniables, puisque cela permettrait d’explorer le comportement des EMA et ses répercussions sur la dynamique des populations1. Il faut encourager de tels dispositifs car ils serviraient à mesurer les effets de l’évolution de l’environnement sur le comportement des animaux, tant au cours d’une même année qu’entre les années, et fourniraient des indications sur les éventuels impacts sur le taux de croissance de la population1. Actuellement, le nombre de spécimens appareillés est faible par rapport à la densité de la population en ZTA (0,005 %) et se concentre principalement (>90 % des dispositifs) sur les femelles en âge de se reproduire. Par conséquent, le principal enjeu est d’appareiller un nombre suffisant d’individus, afin de fournir une compréhension représentative de chaque population, et notamment des populations plus importantes qui se reproduisent en dehors de la ZTA, mais qui s’y nourrissent intensivement. Sans une amélioration du nombre de spécimens échantillonnés, il sera également difficile de quantifier avec précision la proportion de recoupement (sur le plan spatial et sur celui des ressources) entre les zones d’alimentation des EMA et les futures activités de pêche potentielles qui pourraient avoir une interaction négative avec les EMA au sein de la ZTA.
Compte tenu des récents progrès technologiques et de l’utilisation d’approches de modélisation plus sophistiquées, certains des défis susmentionnés peuvent désormais être relevés sans difficulté. Ces études offrent la possibilité de découvrir de façon plus exhaustive comment les EMA pourraient répondre aux activités humaines au fil du temps.
Sans l’intégration de données plus récentes, il sera difficile de comprendre et de prédire comment les bouleversements climatiques passés, en cours et attendus, associés aux répercussions de l’intérêt croissant pour la pêche commerciale, affecteront la population mondiale des EMA. On peut supposer que des influences spécifiques à la région sont à prévoir. Certaines populations de la ZTA pourraient bénéficier d’une augmentation d’un habitat terrestre, alors que d’autres pourraient subir un déclin. En effet, les évolutions dans la disponibilité et la distribution des proies nécessitent des changements de comportement individuel, ce qui entraîne finalement des pertes de population.
De tous les phoques de l’Antarctique, la distribution et l’abondance des EMA tolérants à la glace devraient être les moins affectées par les évolutions des caractéristiques des glaces de mer dues au changement climatique. Avec le recul de la glace, la proportion d’éléphants de mer se reproduisant le long des côtes de l’Antarctique pourrait augmenter à mesure que des habitats de reproduction appropriés deviendront disponibles. Par ailleurs, les EMA peuvent être amenés à ajuster leurs stratégies de recherche de nourriture car les impacts sur les mammifères marins devraient principalement se traduire par des variations dans la distribution et l’abondance des proies.
Les évaluations des effectifs de la population, les évaluations temporelles de l’état du corps de l’éléphant de mer, et le suivi de l’immigration et de l’émigration vers la ZTA par le biais d’études de marquage et de recapture doivent être poursuivis et améliorés. La poursuite d’études plus sophistiquées sur le comportement alimentaire et la recherche de nourriture, à l’aide d’une multitude d’instruments utilisant la technique de bio-logging et des techniques chimiques récemment mis au point, est également nécessaire pour compléter la compréhension globale des effets de la présence humaine sur les EMA. Compte tenu du manque de données récentes par rapport aux données historiques, il serait prématuré, à ce stade, de conclure que les EMA vivant et se nourrissant au sein de la ZTA sont en sécurité dans un proche avenir.






