Julian Gutt (1)*, Andrew Constable (2), Vonda Cummings (3), Graham Hosie (4), Trevor McIntyre (5), Katja Mintenbeck (1), Alison Murray (6), Lloyd Peck (7), Yan Ropert-Coudert (8), Grace K. Saba (9), Oscar Schofield (9), Irene Schloss (10), Jacqueline Stefels (11), Kunio Takahashi (12).
Большая часть живых организмов Южного океана особым образом приспособилась к уникальным условиям Антарктики. Для данного обширного региона характерны низкие температуры, наличие покрытой льдом береговой линии и чётко выраженные сезонные колебания в морском ледовом покрове, световом режиме и биологической продуктивности. Цель данного документа – исследовать чувствительность биоты Южного океана к происходящим в последнее время изменениям и обратить внимание общества и заинтересованных сторон на основные области, вызывающие озабоченность, а также на актуальные направления будущих исследований. Считается, что большинство видов, населяющих Южный океан, чувствительны к изменению климата. Рост микроводорослей, которые служат основой пищевой цепи, очень сильно зависит от ледяного покрова на море. Прогнозируемое уменьшение ледяного покрова будет иметь эффект цепной реакции для высших трофических уровней. Живущие во льду организмы, криль, рыба, пингвины, тюлени и киты будут вынуждены искать новые места обитания или кормовые территории. Однако предельные климатические условия, которые могут привести к гибели сообществ или популяций остаются по большей части неизвестны. Некоторые организмы могут даже выиграть от изменения климата благодаря увеличению воспроизводства и скорости роста.
По общему мнению, Южный океан вносит свой вклад в важные глобальные услуги экосистем. К ним относятся выделение кислорода, поглощение углекислого газа, круговорот питательных веществ, обеспечение кормовых территорий для таких широко распространённых животных, как киты и морские птицы, а также производство биологических продуктов для потребления людьми. Поэтому уязвимость морских организмов перед лицом последствий климатических изменений является очень серьёзной проблемой и в данной статье определяется как восприимчивость таких организмов к соответствующему изменению климата и отсутствие возможностей справляться с этим явлением и адаптироваться к нему (1, 2). Следовательно, чувствительность биологических процессов и экологически важных видов к изменению климата представляет собой важный предмет исследования (рис. 1) (3). Понимание этих проблем крайне необходимо для разработки эффективных стратегий сохранения экосистем и управления ими.

Рис. 1: Ледяная рыба относится к группе организмов, которые лучше всего изучены в отношении их высокой адаптации к низким температурам, что выражается в выработке белков антифриза. Таким образом, эти рыбы, представленные в данном документе видом Pagetopsis macropterus, высокочувствительны к повышению температуры в местах их обитания на морском шельфе в результате подъёма и расширения тёплых водных масс. Отсутствие гемоглобина является ещё одним примером того, как низкие температуры повлияли на эволюцию ледяной рыбы. Фотография: Дж. Гатт © Институт полярных и морских исследований им. Альфреда Вегенера – AWI/ Центр по изучению морской среды (MARUM) университета Бремена.
Морские водоросли участвуют в производстве кислорода и связывании содержащегося в атмосфере углерода посредством процесса фотосинтеза, одновременно образуя органические вещества, обеспечивающие питание организмов более высоких уровней пищевой цепи. Наряду с прогнозируемым увеличением распространения фитопланктона в открытых водах в зонах уменьшения ледяного покрова (и это уже наблюдалось в отдельных местах) (4, 5), отмечается также его уменьшение, когда вследствие потребления и повышенной стратификации воды сокращается количество питательных веществ. Сдвиги в видовом составе от более крупных к менее крупным диатомеям и фитожгутиковым обусловлены изменениями в динамике океана и морского льда, а также изменениями степени минерализации ледников вследствие их таяния (рис. 2) (5, 6). Поскольку фитопланктон находится в основании морской пищевой цепи, такие обусловленные климатом изменения могут влиять на всю морскую экосистему. Сложность и большое биологическое разнообразие других групп антарктических микроорганизмов (бактерий, архей и одноклеточных животных) создают дополнительные проблемы при оценке уязвимости экосистемы в случае климатических изменений. Эти организмы неразрывно связаны с фитопланктоном и имеют большое значение для функционирования экосистемы и её взаимосвязей (например, биогеохимических связей, симбиоза, истребления хищниками; 7).
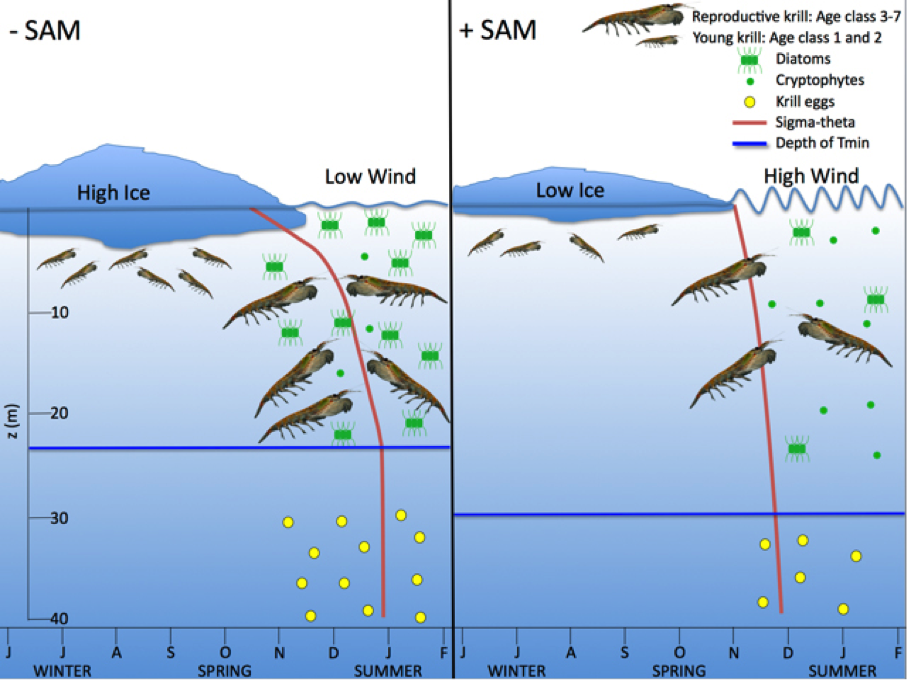
Рис. 2: Влияние масштабных климатических и локальных физических сил на биологические процессы, происходящие на побережье западной части Антарктического полуострова (ЗАП). Обобщённая иллюстрация того, как климатические, погодные и физические океанографические процессы зимнего и весеннего периодов, частично обусловленные фазами Южного кольцевого режима (ЮКР), каскадно переходят от фитопланктона до воспроизводства криля. Разнообразие ЮКР характеризуется противоположными аномалиями атмосферного давления между Антарктикой и средними широтами и отражается в силе субполяных западных ветров, так что холодные южные ветра дуют через ЮКР во время отрицательной фазы ЮКР (левая область), а более тёплые северо-западные ветра дуют над ЗАП во время положительной фазы ЮКР (правая область). Обычно диатомеи являются самым многочисленным типом фитопланктона и любимой пищей для криля в прибрежных водах ЗАП. Жгутиковые криптофиты могут временами доминировать в ЗАП и, вследствие их малого размера, недостаточно эффективно поедаются крилем. Температурный минимум (Tmin) – верхняя граница холодного остаточного зимнего водного слоя в регионе. Сигма-тета – градиент плотности морской воды между Tmin и поверхностью – чем больше изогнута линия, тем больше градиент плотности. Фитопланктон, криль, икра криля и сигма-тета обобщены для качественного отображения процессов («больше» против «меньше») и не представляют количественную разницу между противоположными событиями ЮКР. Примечание: самки антарктического криля нерестятся в глубоких водах; данная иллюстрация описывает соответствующий объём нереста. Из Saba et al 2014 (6).
Плотность скопления микроводорослей в нижних слоях морского льда обычно в 1000 раз выше, чем в морской воде. Когда тает лёд и микроводоросли опускаются на морское дно, они становятся богатым источником пищи для зоопланктона, а также сообществ, обитающих на дне моря (бентоса). В случае реализации сценария сокращения морского льда распространение многих видов сократится. Многочисленным веслоногим, таким как Drescheriella glacialis, морской лёд необходим в качестве места размножения или роста (8). Антарктический криль (Euphausia superba) и антарктическая серебрянка (Pleuragramma antarctica) также зависят от морского льда в течение части своего жизненного цикла. Они являются преобладающими видами и представляют собой богатые энергией трофические связи между планктоном и высшими хищниками. Очевидно, что нарушение их воспроизводства является следствием потепления и отступления морского льда (9, 10). Их полное исчезновение и частичная замена энергетически бедными желеобразными сальпами в отдельных местах Антарктического полуострова подтверждает их уязвимость и первые реакции на изменение климата. Уменьшение численности этих основных видов и другой биоты морского льда по цепочке отразится на высших трофических уровнях и долгосрочном здоровье экосистемы.
Зоопланктон является важнейшим звеном в пищевой цепи, так как он питается фитопланктоном и микробами и служит пищей для высших организмов. Повышение температуры, вероятно, приведёт к уменьшению численности видов, приспособившихся к крайне холодному климату (например, криля Euphausia cystallorophias), уступив место видам, устойчивым к тёплой воде, например мелким веслоногим Oithona similis. Прогнозируется, что обитающие в тёплой воде виды будут также мигрировать к югу и могут вытеснить вблизи континента холодостойкие виды, которые не смогут уйти ещё дальше на юг. С другой стороны, в ближайшем будущем в некоторых районах возрастёт численность фораминифер вследствие сложных экологических причин (11) Закисление океана представляет собой дополнительную опасность для антарктических экосистем. Оно может повлиять на развитие и физиологию не только тех видов, которые имеют карбонатнокальциевые раковины, например, на птероподов (крылоногих моллюсков), но и на криль, приведя к долгосрочному сокращению популяции. Это отразится на всей морской экосистеме и может привести к изменению объёмов поглощаемой океаном из атмосферы двуокиси углерода.
Бентос играет важную роль в круговороте углерода и питательных веществ, а также в разнообразии морских организмов в целом. В лабораторных исследованиях антарктические бентические беспозвоночные, особенно более крупные виды, показали меньшую устойчивость к потеплению, чем виды умеренного климата, хотя, согласно наблюдениям, они перенесли прогнозируемые повышения температуры, которые уже отмечаются к западу от Антарктического полуострова (рис. 3) (3, 12, 13). Хотя некоторые виды обладают высокой тепловой устойчивостью, исчерпывающих знаний о пороговых значениях чувствительности организмов к климатическим изменениям в целом не хватает.
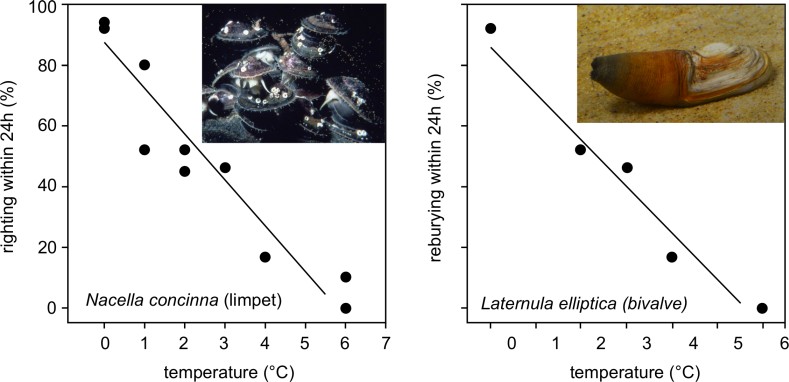
Рис. 3: Влияние температуры на поведение двух бентических антарктических морских беспозвоночных. Слева: моллюск Nacella concinna; данные показывают процентную долю особей, способных выпрямляться в течение 24 ч после их опрокидывания. Справа: двустворчатый моллюск Laternula elliptica; данные показывают процентную долю особей, успешно углубившихся в грунт в течение 24 ч после их извлечения из осадочного слоя. Линия показывает наименьшую квадратичную регрессию, подобранную после арксинус-преобразования данных. Графики упрощены в соответствии с Clark et al 2007 (12); фотографии © BAS (слева), Л. С. Пек (справа).
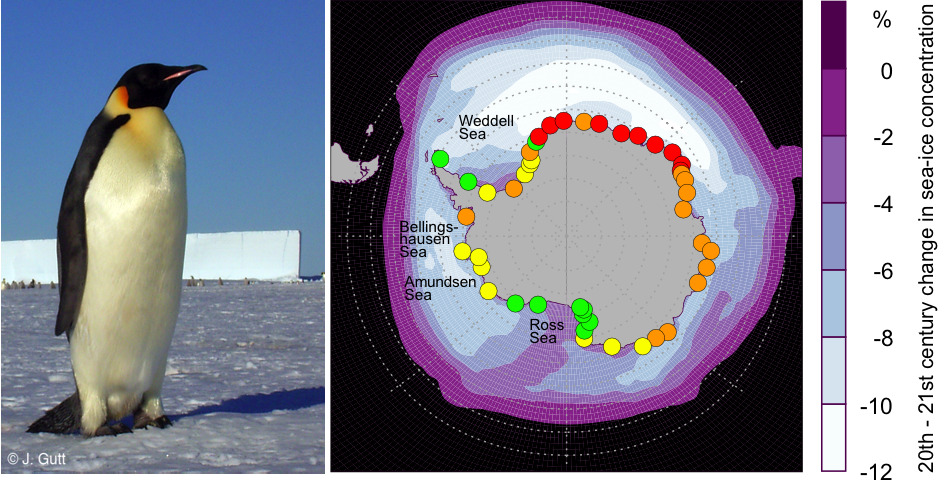
Рис. 4: Прогнозируемые расположения колоний императорских пингвинов (обозначены точками) с охранным статусом на конец XXI века (красным цветом обозначены: «полувымершие колонии», оранжевым цветом: «вымирающие колонии», жёлтым цветом: «уязвимые колонии», зелёным цветом: «не подвергающиеся опасности колонии». Ежегодное среднее изменение концентраций морского льда между XX и XXI веками, обозначенное светло-голубым/сиреневым цветом. Карта обновлена после выпуска Jenouvrier et al 2014 (17). Фотография: © Дж. Гатт.
Морские высшие хищники также служат индикаторами состояния экосистем, и в настоящий момент их будущее видится неопределённым. Хотя исчезновение льда на полуострове привело к серьёзному сокращению обитающих на нём популяций, общая численность пингвинов Адели остаётся стабильной и даже растёт в некоторых отдельных местах. Тем не менее, имеются признаки того, что ситуация может быстро измениться: недавно зарегистрированные крайние показатели распространения морского льда наряду с необычными дождливыми периодами в Восточной Антарктике привели к увеличению протяжённости кормовых путешествий и, в конечном итоге, к полному нарушению размножения в предположительно устойчивой зоне (14). На основе методов моделирования прогнозируется уменьшение популяций легендарного императорского пингвина в масштабах континента и практически его вымирание в отдельных районах к концу этого века (рис. 4) (15). Более того, изменившаяся картина ныряния южных морских слонов свидетельствует о том, что им приходится прилагать больше усилий для добывания пищи в теплеющем Южном океане (16).
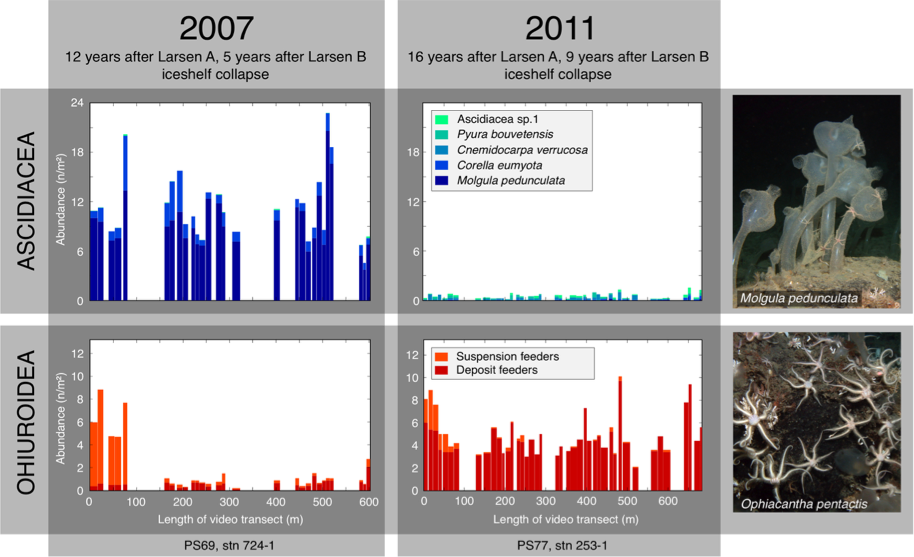
Рис. 5: Изменения численности асцидий (вверху) и офиур (внизу) в зонах A и B ледника Ларсена на Антарктическом полуострове после разрушения ледникового шельфа, установленные с помощью видеосъёмки дистанционно управляемыми подводными манипуляторами (ROV). Перерисовано после выпуска Gutt et al 2013 (15). Фотографии морского дна Дж. Гатт © Институт полярных и морских исследований им. Альфреда Вегенера – AWI/ Центр по изучению морской среды (MARUM) университета Бремена.
Изменение климата может затронуть не только отдельные виды, но и целые сообщества (17). Это происходит по мере увеличения масштабов разрушения дна шельфа подводными частями айсбергов, отступления ледников и изменений в морском ледяном покрове (18, 19). Морская экосистема в целом также изменяется в результате разрушения шельфового льда, когда крайне энергетически-бедная система перемещается в более «нормальные» антарктические условия с интенсивным ростом микроводорослей, служащих пищей для животных-потребителей в короткий летний период (20). В результате такие бентические организмы, как губки, асцидии и офиуры могут демонстрировать неожиданно быстрый рост популяции и высокую смертность (рис. 5) (20, 21). Как правило, уязвимости таких систем могут вызвать нисходящие цепные реакции в пищевой цепи, направленные на конкурирующие или восходящие силы в зависимости от того, на какие типы организмов и как оказывается влияние (17). Неизвестна способность к самовосстановлению (устойчивость) многих видов или сообществ, хотя эволюционные процессы могут привести к временной генетической адаптации, особенно в микроорганизмах.
Знаем ли мы достаточно о том, как изменение климата влияет на биоразнообразие Южного океана, экологические процессы и услуги, предоставляемые экосистемами? Нет. Нам необходимы дополнительные междисциплинарные и согласованные на международном уровне исследования для мониторинга основных видов, их адаптируемости и условий окружающей среды, определяющих их характеристики. Необходимы долгосрочные полевые эксперименты, исследования связей экосистем и моделирование будущего развития событий, в том числе влияний многочисленных стресс-факторов и нелинейных биологических взаимодействий (19, 22). Наконец, такая информация должна обеспечить основу для комплексной оценки уязвимости биоты Южного океана, внедрению рациональных охранных мер и эффективных мер управления.
Здесь представлены конкретные проекты, которые помогли значительно углубить знания об уязвимости экосистем Южного океана с помощью комплексного анализа или непосредственного понимания ситуации на основе уникальной, неожиданной информации или данных более широкого контекста.
1926 г.
Исследования «Дискавери» обеспечили околополярные исходные данные для долгосрочных наблюдений за запасами криля (см. 1980-е гг.).
1960 г.
Начало физиологических исследований адаптации антарктической рыбы к узкому температурному диапазону.
1967 г.
Экологические исследования губок в проливе Мак-Мёрдо обеспечили основу для долгосрочного изучения их чувствительности к изменениям окружающей среды (см. 2004 г./2010 г.).
1977 г.
Пробуренная в шельфовом леднике Росса скважина дала возможность впервые наблюдать за живыми организмами далеко за пределами антарктического ледового шельфа и выполнять необходимые измерения, в результате чего были получены экстремально низкие показатели метаболизма, обусловленные олиготрофными условиями.
Конец 1970-х гг.
Первые биомолекулярные исследования механизмов антиобледенения, особенно у белокровных рыб, показали наличие хорошо развитых функций адаптации к температурам ниже точки замерзания, и, соответственно, устойчивость таких организмов к низким температурам.
1980-е гг.
Международная программа биологических исследований морских антарктических систем и ресурсов (BIOMASS) стала вторым исследованием после исследований «Дискавери», направленным на оценку чувствительности ресурсов криля к условиям окружающей среды. https://legacy.bas.ac.uk/bas_research/data/access/esodap/biomass.php
1989 г.
Программа мониторинга экосистемы (CEMP) Комиссии по сохранению морских живых ресурсов (АНТКОМ), наряду с другими целями, была призвана определить изменения в популяциях промысловых видов вследствие изменений окружающей среды. https://www.ccamlr.org/en/organisation/achievements-and-challenges#CEMP
1990 г.
На станции Палмер была запущенаДолгосрочная программа экологических исследований (LTER) с целью отслеживания динамических показателей экосистем краевой зоны покровного льда и биогеохимического круговорота на западе Антарктического полуострова. http://pal.lternet.edu/
1990-е гг.
Эра молекулярных исследований открыла связи с мировым океаном, высокую чувствительность к временным отклонениям, нишевое разделение в таких уязвимых экосистемах, как морской лёд, высоко адаптированные к холоду микроорганизмы в пелагических экосистемах и экосистемах морского льда.
1991 г.
Было начато исследование с использованием устройства для непрерывного анализа проб планктона в Южном океане (CPR) с целью изучения долгосрочного здоровья и биоразнообразия пелагической системы. https://data.aad.gov.au/aadc/cpr/index.cfm
2000-е гг.
Началась эра современных исследований структуры и функционирования генетического материала («омики»). Такие методы дали новые возможности для исследования адаптации живых организмов к уникальным антарктическим условиям и уязвимости организмов перед лицом последствий изменения климата.
2004 г./2010 г.
Через четыре десятилетия было возобновлено исследование бентоса в проливе Мак-Мёрдо; обнаружено неожиданно быстрое воспроизводство и смертность губок.
2006-2007 гг.
Первое крупномасштабное исследование позволило интерпретировать данные об изменении сред обитания под шельфовым ледником после его разрушения вследствие климатических изменений в заливах A и B ледника Ларсена. Значительный вклад в Международный полярный год (МПГ).
2007 г.
Впервые аспекты уязвимости полярной экосистемы включены в отчёт Межправительственной группы экспертов по изменению климата (МГЭИК) (четвёртая оценка).
2009 г.
СКАР опубликовал отчёт Об изменениях климата и окружающей среде Антарктики (ACCE), включая описание прошлого, текущего и будущего развития биоты Южного океана. http://www.scar.org/accegroup/accegroup-publications
2012 г.
Проводимое на протяжении 16 лет исследование в бухте Поттер (остров Кинг-Джордж) выявило высокую уязвимость бентических организмов-фильтраторов к повышенному осадкообразованию вследствие таяния ледников из-за изменения климата. Этот может служить примером влияния дальнейшего отступления ледников с суши на прибрежные места обитания.
2013 г.
Запущена программа СКАР Антарктические пороги — устойчивость и адаптация экосистемы (AnT-ERA), чтобы установить признанные на международном уровне цели и методы исследований биологических процессов, особенно тех, которые относятся к изменению климата. http://www.scar.org/srp/ant-era





