Julian Gutt (1)*, Andrew Constable (2), Vonda Cummings (3), Graham Hosie (4), Trevor McIntyre (5), Katja Mintenbeck (1), Alison Murray (6), Lloyd Peck (7), Yan Ropert-Coudert (8), Grace K. Saba (9), Oscar Schofield (9), Irene Schloss (10), Jacqueline Stefels (11), Kunio Takahashi (12).
L’essentiel de la vie de l’océan Austral est spécifiquement adapté à l’environnement unique de l’Antarctique. Cette vaste région est caractérisée par une faible température, un littoral englacé, et une saisonnalité marquée de l’extension de la banquise, du régime lumineux et de la productivité biologique. Ici, nous examinons la vulnérabilité des espèces vivantes de l’océan Austral face aux changements récents pour informer le public et les parties prenantes dans la région sur les principaux sujets de préoccupation et les champs d’études les plus urgents pour le futur. La plupart des espèces qui peuplent l’océan Austral sont supposées être sensibles au changement climatique. La croissance des micro-algues, qui constituent la base de la chaîne alimentaire, dépend essentiellement de la couverture de glace. La réduction prévisible de celle-ci aura des effets en cascade sur les niveaux trophiques supérieurs. Les organismes vivant dans les glaces, le krill, les poissons, les manchots, les phoques et les baleines devront trouver de nouveaux habitats ou des nouvelles aires d’alimentation. Toutefois, les seuils des conditions climatiques qui conduiraient à l’effondrement des populations ou des communautés sont largement inconnus. Certains organismes pourraient même bénéficier du changement climatique grâce à une augmentation des taux de reproduction et de croissance.
Il est généralement admis que l’océan Austral contribue de manière importante à aux services écosystèmiques à l’échelle planétaire à travers la production d’oxygène, l’absorption de dioxyde de carbone, le recyclage des nutriments, des production d’aires d’alimentation pour des animaux largement distribués comme les baleines et les oiseaux de mer, et la fourniture de produits biologiques pour l’homme. La vulnérabilité des organismes marins au changement climatique est donc d’une importance cruciale et cet article s’intéresse à leur sensibilité à un changement environnemental et à leur incapacité à y faire face et s’y adapter (1, 2). Par conséquent, la sensibilité des processus biologiques et des espèces écologiquement importantes face au changement climatique est un sujet de recherche primordial (Fig. 1) (3). Les connaissances sur ces questions répondent à un besoin urgent de développer des stratégies de conservation et de gestion des écosystèmes.

Fig. 1: Les poissons des glaces constituent le groupe d’organismes le mieux étudié en termes d’adaptation étroite aux basses températures, caractérisée par le développement de protéines antigel. Ainsi, ces poissons, représentés ici par l’espèce Pagetopsis macropterus, sont très vulnérables à l'augmentation de la température de leurs habitats à la surface de la mer, et par la propagation et l'expansion des masses d'eau chaude. Le manque d'hémoglobine est un autre exemple de la manière selon laquelle les basses températures ont affecté l’évolution des poissons des glaces. Photo: J. Gutt © AWI / Marum, Université de Brême
Les algues marines contribuent à la production d’oxygène et à la séquestration du CO2 atmosphérique par photosynthèse, tout en produisant de la matière organique qui bénéficie aux niveaux plus élevés de la chaîne alimentaire. Alors que la croissance du phytoplancton en eau ouverte est prévue augmenter dans les zones de réduction de la banquise (ce qui a déjà été localement observé) (4, 5), elle diminue lorsque les nutriments sont réduits en raison de leur consommation et de l’augmentation de la stratification de l’eau. Des changements dans la composition des espèces de diatomées et phytoflagellés, des plus grands aux plus petits, sont entraînés par les changements de la glace de mer et de la dynamique des océans, ainsi que par la variabilité de la salinité induite par la fonte des glaces (Fig. 2) (5, 6). Etant donné que le phytoplancton est la base de la chaîne alimentaire marine, de telles modifications provoquées par les changements climatiques peuvent affecter l’ensemble de l’écosystème marin. La complexité et la grande diversité biologique des autres groupes microbiens antarctiques (bactéries, archées et animaux unicellulaires) posent des défis supplémentaires pour l’évaluation de la vulnérabilité des écosystèmes aux changements climatiques. Ces organismes sont inextricablement liés au phytoplancton et jouent un rôle essentiel dans le fonctionnement des écosystèmes et leurs interactions (par exemple interactions biogéochimiques, symbiose ou prédation; 7).
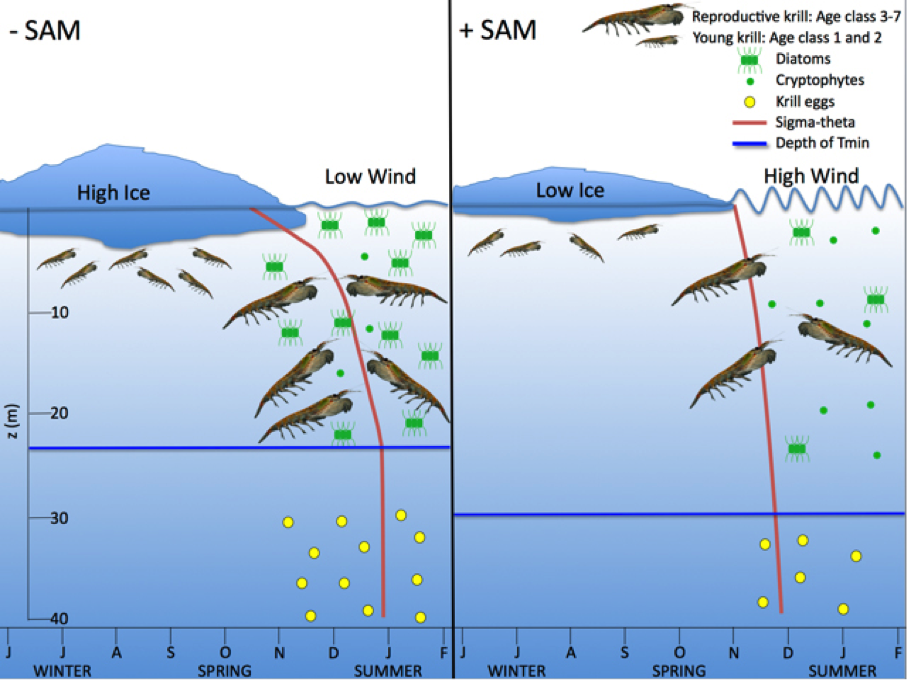
Fig. 2: Effets du climat à grande échelle et du forçage physique local sur les processus biologiques du littoral ouest de la Péninsule antarctique (OPA). Illustration générale résumant la manière dont le climat de l’hiver et du printemps, la météorologie et les processus océanographiques physiques, influencés en partie par les phases de l'oscillation annulaire du sud ou oscillation antarctique (SAM), agissent en cascade, de la production phytoplanctonique à la reproduction du krill. La variabilité du SAM est caractérisée par les antagonismes des anomalies de pression atmosphérique entre l'Antarctique et les latitudes moyennes et se reflète dans la force des vents d’ouest subpolaires, de sorte que les vents froids du sud se déplacent à travers l’OPA au cours d'une SAM négative (panneau de gauche) et des vents du nord-ouest chauds soufflent sur l’OPA lors d'une SAM positive (panneau de droite). Les diatomées sont typiquement le phytoplancton le plus abondant et constituent une nourriture favorable pour le krill dans les eaux côtières près de l’OPA. Les cryptophytes flagellés peuvent dominer parfois dans l’OPA mais, en raison de leur petite taille, ne sont pas consommés de manière efficace par le krill. La température minimale (Tmin) est la limite supérieure de la couche d’eau froide restant de l'hiver précédent dans la région. Sigma-thêta est le gradient de densité d’eau de mer entre la surface et Tmin - plus la ligne est incurvée, plus le gradient de densité est important. Le phytoplancton, le krill, les œufs de krill, et sigma-theta sont représentés à tire d'illustration qualitative (plus vs moins) et ne représentent pas des différences quantitatives entre les événements opposés de SAM. Note: la femelle Euphausia superba va frayer dans des eaux plus profondes; cette illustration est destinée à représenter la production relative d’œufs. De Saba et al 2014 (6).
Les micro-algues dans les couches inférieures de la banquise sont typiquement 1000 fois plus denses que dans l’eau de mer. Elles constituent une source de nourriture particulièrement riche pour le zooplancton, ainsi que pour les communautés du fond marin (benthos) lorsque la glace fond et que les micro-algues descendent vers les fonds marin. Dans les scénarios de réduction de la banquise, de nombreuses espèces vont voir leur distribution diminuer. Des espèces de copépodes abondantes comme Drescheriella glaciallis ont besoin de la glace de mer comme zone d’alimentation et de croissance (8). Le krill antarctique (Euphausia superba) et la calandre antarctique (Pleuragramma antarctica) dépendent aussi de la banquise pendant une partie de leur cycle de vie. Ce sont des espèces dominantes qui représentent des liens trophiques riches en énergie entre le plancton et les grands prédateurs. Apparemment, la baisse du recrutement du krill et de la calandre est une conséquence du réchauffement et de la réduction des glaces de mer (9, 10). Leur disparition locale et leur remplacement partiel par des salpes gélatineux pauvres en énergie de la péninsule antarctique démontrent leur vulnérabilité et leurs premières réponses aux changements climatiques. Le déclin de ces espèces clés et d’autres espèces associées à la banquise aura des effets en cascade sur les niveaux trophiques plus élevés et sur la santé des écosystèmes à long terme.
Le zooplancton constitue également un maillon essentiel de la chaîne alimentaire, car il se nourrit de phytoplancton et de microbes, et fournit de la nourriture pour les organismes supérieurs. L’augmentation de la température de l’eau va probablement induire une diminution du nombre d’espèces adaptées au froid extrême (par exemple, le krill de glace Euphausia crystallorophias) favorisant des espèces tolérantes aux eaux chaudes, comme le petit copépode Oithona similis. Il est prévisible que les espèces d’eaux chaudes migrent également vers le sud et déplacent des espèces d’eaux froides près du continent, où elles seront incapables d’aller plus au sud. D’autre part, on constate que les foraminifères augmentent rapidement dans certaines régions, pour des raisons écologiques complexes (11). L’acidification des océans constitue une menace supplémentaire pour les écosystèmes antarctiques. Elle peut affecter le développement des organismes et la physiologie non seulement des espèces avec des coquilles en carbonate de calcium, comme par exemple les ptéropodes (escargots de mer papillons), mais aussi le krill, entraînant une baisse à long terme des populations. Cela aura une incidence sur l’ensemble de l’écosystème marin et pourrait modifier l’absorption du CO2 atmosphérique par l’océan.
Le benthos contribue de manière significative aux cycles du carbone et des éléments nutritifs et à l’ensemble de la biodiversité marine. Dans des études de laboratoire, les invertébrés benthiques de l’Antarctique, en particulier les espèces plus grandes, sont moins résistantes au réchauffement que les espèces tempérées même si leur survie a été observée pour des plages d’augmentation des températures semblables à celles actuellement observées dans l’Ouest de la Péninsule antarctique (Fig. 3) (3, 12, 13). Alors que certaines espèces ont une tolérance thermique élevée, la connaissance approfondie de leurs seuils de réponse aux changements environnementaux est généralement médiocre.
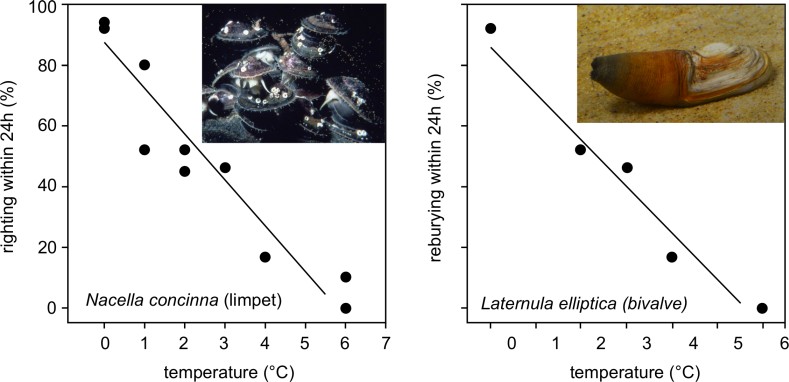
Fig. 3: Effet de la température sur le comportement de deux invertébrés benthiques marins de l'Antarctique. A gauche: Le bivalve Nacella concinna; les données montrent que le pourcentage d'individus capables de se redresser dans les 24 heures une fois retourné. A droite: Le bivalve elliptica Laternula; les données montrent le pourcentage d’individus capables de s’enfouir à nouveau dans les 24 h lorsqu'ils sont retirés du sédiment. La ligne montre la régression des moindres carrés après transformation arcsinus des données. Graphiques simplifiées d’après Clark et al 2007 (12); photos © BAS (à gauche), L.S. Peck (à droite).
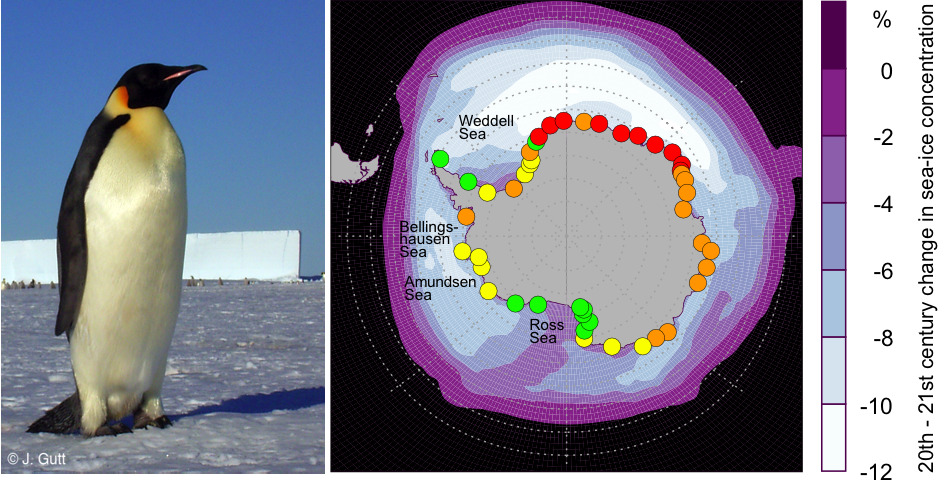
Fig. 4: Distribution des colonies de manchots empereurs (points) avec leur statut de conservation prévu pour la fin du 21ème siècle (rouge: 'quasi extinction ', orange: «en danger», jaune: «vulnérable», vert: Pas menacé). La variation moyenne annuelle de la banquise entre les 20ème et 21ème siècles en bleu clair/ violet. Carte modifiée d’après Jenouvrier et al 2014 (17) Photo:© J. Gutt
Les grands prédateurs marins servent également d’indicateurs de l’état des écosystèmes, et ils indiquent actuellement un avenir incertain. Alors que la disparition de la glace de la Péninsule a conduit à une réduction importante des populations de manchots Adélie, la population globale cette espèce est stable à l’échelle du continent antarctique, et est même en augmentation par endroit. Pourtant, il y a des signes suggérant que la situation pourrait évoluer rapidement : les récentes extensions extrêmes de l’étendue de la banquise, couplées avec des épisodes pluvieux inhabituels dans l’Antarctique oriental ont conduit à une augmentation des distances de nourrissage et, au final, à un échec complet de la reproduction de ces animaux dans une zone où leurs populations étaient pourtant supposée stable (14). En ce qui concerne le manchot empereur, espèce emblématique, les modèles prévoient une baisse des effectifs à l’échelle du continent et presque une extinction dans certaines régions d’ici la fin de ce siècle, (Fig. 4) (15). En outre, la modification des plongées des éléphants de mer suggèrent que cette espèce devra faire plus d’effort pour trouver sa nourriture dans un océan Austral en réchauffement (16).
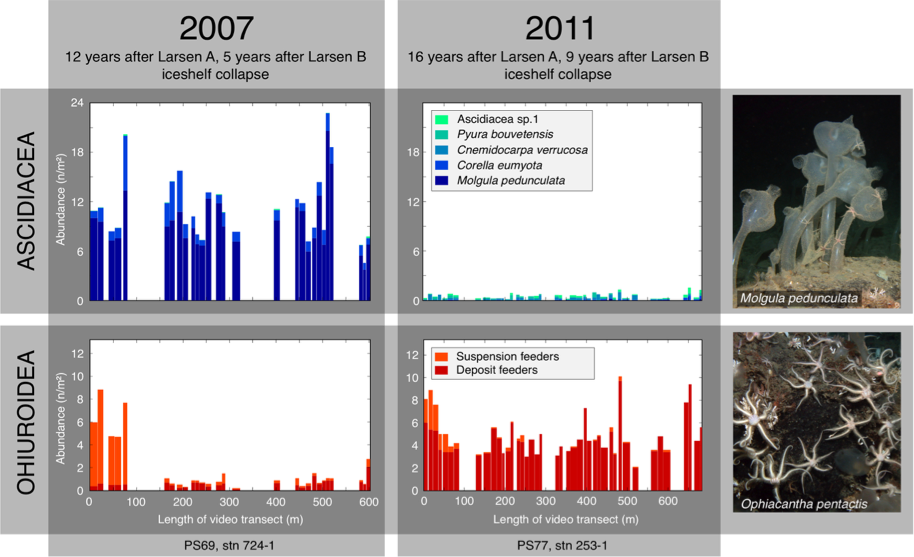
Fig. 5: Les changements de peuplement des ascidies (en haut) et des ophiures (en bas) dans les zones Larsen A / B à l’est de la Péninsule antarctique après l’effondrement de la plateforme de glace, obtenus par des enregistrements vidéo sur des transects réalisés à partir d’un ROV. Redessiné après Gutt et al 2013 (15). Photographies des fonds marins: J. Gutt © AWI / Marum, Université de Brême.
Ce n’est donc pas une simple espèce, mais des communautés entières qui peuvent être affectées par le changement climatique (17). Cela va de paire avec l’augmentation des icebergs labourant les fonds marins, le recul des glaciers et les changements dans la couverture de la banquise (18, 19). L’ensemble de l’écosystème marin est également modifié par la désintégration des plateformes glaciaires faisant passer un système extrêmement pauvre en éléments nutritifs à un système aux conditions plus «normales» pour l’Antarctique, avec une croissance intensive de micro algues servant de nourriture pour des consommateurs lors du court été austral (20). En conséquence, les organismes benthiques comme les éponges, les ascidies et les ophiures, peuvent présenter de manière inattendue une croissance démographique très rapide et une mortalité élevée (Fig. 5) (20, 21). Généralement les vulnérabilités de tels systèmes peuvent donner lieu à des effets en cascades, du haut vers le bas de la chaîne alimentaire, ou a l’inverse des effets ascendants, suivant quels types d’organismes sont touchés et selon quelles modalités (17). La capacité d’autoréparation (résilience) est peu connue pour nombre de ces espèces ou communautés, bien que les processus évolutifs puissent entraîner sur le long terme une adaptation génétique, en particulier dans les micro-organismes.
Est-ce que nous en savons déjà assez sur l’impact du changement climatique sur la biodiversité de l’océan Austral, sur les processus écologiques et sur les services qu’ils fournissent à l‘écosystème? Non – nous avons besoin d’études plus interdisciplinaires et coordonnées au niveau international pour surveiller les espèces clés, leur capacité d’adaptation et l’environnement qui les façonne. Des expérimentations in situ à long terme, des études sur les liens entre les écosystèmes et le développement de simulations futures qui incluent les effets de multiples facteurs de stress et les interactions biologiques non linéaires sont nécessaires (19, 22). Enfin, de telles informations devraient servir de base à une évaluation globale de la vulnérabilité des espèces de l’océan Austral, à l’établissement de mesures de conservation et à la mise en œuvre d’actions de gestion efficaces.
Ceux-ci représentent des projets spécifiques qui ont contribué de manière significative à la connaissance de la vulnérabilité des écosystèmes de l’océan Austral, soit de manière globale, soit en fournissant des informations directes uniques, inattendues ou d’une pertinence plus large.
1926
Discovery Investigations fournit une base de référence circumpolaire pour les observations à long terme sur les stocks de krill (voir années 80s).
1960
Début des études physiologiques sur l’adaptation des poissons de l’Antarctique à une fenêtre étroite de température.
1967
Des études écologiques sur les éponges à McMurdo Sound fournissent la base d’une étude à long terme sur leur sensibilité à la variabilité environnementale (voir 2004/2010).
1977
Un forage dans le Ross Ice Shelf offre la possibilité pour les premières observations et mesures de la vie en dessous du manteau glaciaire loin des bords de la banquise, montrant des taux métaboliques extrêmement faibles en raison des conditions oligotrophes.
Fin années 70
Les premières études biomoléculaires sur les mécanismes antigel en particulier chez les poissons à sang blanc, indiquent une forte adaptation aux basses températures en dessous du point de congélation et, par conséquent, une tolérance aux faibles températures.
Années 80
L’international Biological Investigations of Marine Antarctic Systems and Stocks program (BIOMASS) marque une deuxième étude après les Discovery Investigations pour évaluer la sensibilité environnementale des stocks de krill. https://legacy.bas.ac.uk/bas_research/data/access/esodap/biomass.php
1989
Ecosystem Monitoring Program (CEMP) de la Commission for the Conservation of Antarctic Marine Resources (CCAMLR) a, entre autres objectifs, de déterminer les changements dans les espèces commerciales en raison de la variabilité environnementale. https://www.ccamlr.org/en/organisation/achievements-and-challenges#CEMP
1990
Le programme Long-Term Ecological Research (LTER) est établi à Palmer pour surveiller la dynamique des écosystèmes des zones marginales de la banquise et le cycle biogéochimique de l’Ouest de la Péninsule antarctique. http://pal.lternet.edu/
Années 90
L’ère moléculaire a révélé la connectivité de l’océan mondial, une haute sensibilité à la variation temporelle, la séparation des niches dans les écosystèmes vulnérables tels que la banquise, les micro-organismes fortement adaptés au froid dans les écosystèmes pélagiques et la glace de mer.
1991
Début de Southern Ocean Continuous Plankton Recorder (CPR) Etude pour étudier la santé à long terme et la biodiversité du système pélagique. https://data.aad.gov.au/aadc/cpr/index.cfm
Années 2000
Début de l’ère des études avancées sur la structure et le fonctionnement du matériel génétique («omiques»). Ces approches offrent de nouvelles opportunités pour enquêter sur l’adaptation aux conditions uniques de l’Antarctique et la vulnérabilité des organismes aux changements environnementaux.
2004/2010
Un site d’étude du benthos à McMurdo Sound est revisité après quatre décennies; un recrutement rapide inattendu et la mortalité des éponges sont observés.
2006/2007
Une première étude à grande échelle permet des interprétations sur les changements des habitats sous la glace après les effondrements de plateformes glaciaires induits par le climat dans les échancrures Larsen A et B. Contribution majeure à l’International Polar Year (IPY).
2007
Pour la première fois, des aspects temporels de la vulnérabilité des écosystèmes polaires sont inclus dans le rapport du Groupe d’Etude Intergouvernemental sur le Climat GIEC (Quatrième évaluation).
2009
Le rapport Antarctic Climate and the Environment (ACCE) incluant les développements passés, présents et futurs desèces de l’océan Austral est publié par le SCAR. http://www.scar.org/accegroup/accegroup-publications
2012
Une étude sur plus de 16 ans à Potter Cove, Ile du Roi George, a révélé une vulnérabilité élevée des filtreurs benthiques à une sédimentation accrue en raison de la fonte des glaces due au climat. Elle peut servir d’étude de cas sur l’impact d’une déglaciation terrestre ultérieure dans le cas des habitats proches du rivage.
2013
Le programme du SCAR Antarctic Thresholds – Ecosystem Resilience and Adaptation (AnT-ERA) fournit un cadre international pour les études des processus biologiques, particulièrement en rapport au changement climatique. http://www.scar.org/srp/ant-era





